猪血凝性脑脊髓炎病毒(PHEV)是冠状病毒科、β冠状病毒属、Embecovirus亚属成员,具有典型嗜神经特性,可引起仔猪/成年猪发生脑脊髓炎、呕吐和消瘦病(VWD)或流感样疾病(ILI)。PHEV感染机体后沿外周神经向中枢神经传递,神经细胞是病毒侵害的靶细胞,整个感染过程无病毒血症。外泌体(exosomes)是由细胞内多泡体(MVBs)向外分泌的膜性囊泡,其作为细胞间通讯的信使,参与了多种RNA病毒及其宿主之间的“战争与和平”再现。PHEV感染诱导神经细胞内形成大量膜性囊泡结构(如自噬小体、双膜囊泡、自噬溶酶体等)已被证实,那么外泌体传递途径是否可能是PHEV感染扩散的潜在机制之一?
近日,吉林大学动物医学学院贺文琦教授团队在mBio发表题为“Porcine Hemagglutinating Encephalomyelitis Virus Co-Opts Multivesicular-Derived Exosomes for Transmission”的研究文章(doi: 10.1128/mbio.03054-22)。研究发现宿主外泌体分泌与病毒感染之间的新联系,证明了MVBs来源的外泌体是病毒感染传播的模式之一,它们介导宿主先天免疫信号分子和特定病毒成分由受感染神经细胞向临近非易感神经免疫细胞的转移。
该团队的前期研究已经阐明了PHEV入侵神经细胞的途径以及病毒在神经细胞内的转运方式等重要机制(Journal of Virology, 2017, 2019),并证实PHEV经呼吸道暴露后可以经嗅神经和三叉神经侵入到脑组织(Plos Pathogens, 2022)。但是,PHEV在细胞之间的传播方式还不明确。
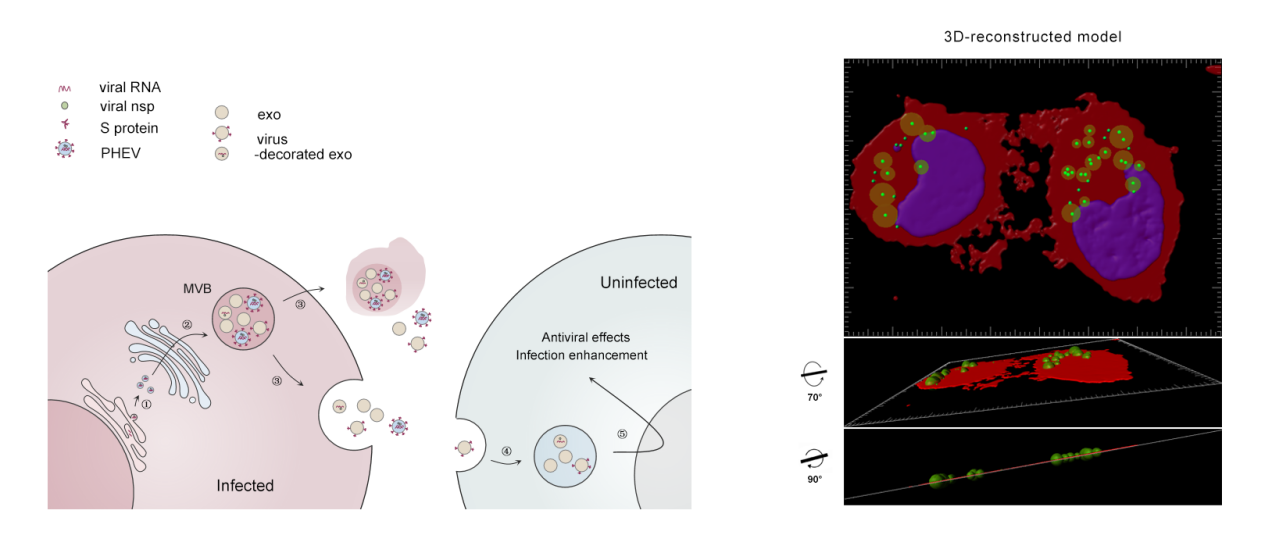
在这项研究中,研究者首先获得了PHEV感染与未感染的小鼠神经母细胞瘤细胞(N2a)来源的两种外泌体,即PHEV-exos和Ctrl-exos,利用透射电镜技术(TEM)、免疫电镜技术(IEM)、纳米颗粒跟踪分析(NTA)、流式细胞术(FCM)等验证了外泌体的形态、结构和含量特征。结果显示,封闭的MVBs内充满了大量的病毒粒子、外泌体、致密体等结构,其中PHEV-exos直径约为50~100 nm,其外膜表面可被装饰呈穗状结构,且形态与PHEV病毒粒子表面S糖蛋白结构相似,文中称之为“病毒装饰的外泌体”。这提示外泌体和冠状病毒颗粒由受感染细胞同时释放,并在质膜或多泡体上共享生物发生途径。转录组学分析发现,PHEV-exos携带多种成分,包括宿主先天免疫传感器(PRRs)、干扰素刺激基因(ISGs)和某些特定病毒成分。鉴于外泌体生物发生和病毒复制周期之间的密切关系,该研究使用transwell系统来监测PHEV RNA复制中间体的传播,结果表明,在与PHEV感染的N2a细胞共培养24小时后,在非易感的小胶质细胞中很容易检测到病毒非结构蛋白(nsp1、2、4、5、7、8)和亚基因组RNA片段(sgRNAs),且抑制外泌体分泌可抑制PHEV感染。进一步,利用荧光染料PKH67标记小胶质细胞来源的外泌体,经示踪及生物模拟分析发现,N2a细胞表现出对小胶质细胞分泌的外泌体的高效摄取,并通过MVBs途径进行转运。该结果表明,PHEV感染细胞可以通过排出外泌体和病毒粒子的混合物与附近或远处的细胞进行“信息交流”,如转运特定病毒成分或宿主抗病毒信号分子,从而促进病毒感染性传播。
综上所述,该研究证明PHEV修饰的外泌体在感染传播及宿主-病原体对抗中的重要作用,它们可以被认为是病原体相关分子模式载体,介导免疫刺激物从感染细胞转移到未感染细胞。这些研究结果提示,作为功能纳米材料,外泌体具有更安全、更有效的治疗特性,MVBs来源的外泌体转移过程具有作为治疗冠状病毒感染性疾病的新型基因工程方法与传递系统的巨大潜力。(吉林大学李姿副教授为论文第一作者,贺文琦教授为通讯作者。该研究得到了十四五国家重点研发计划青年科学家项目、国家自然科学基金等项目的资助)。
参考文献:Porcine Hemagglutinating Encephalomyelitis Virus Co-Opts Multivesicular-Derived Exosomes for Transmission. mBio.2022 Dec 21:e0305422. doi: 10.1128/mbio.03054-22.