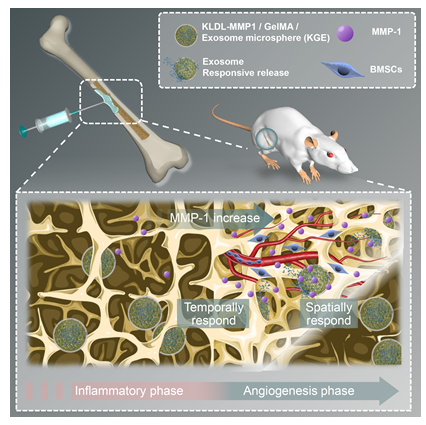
外泌体可以通过促进血管生成、调节免疫、促进干细胞定向分化来修复骨缺损。研究显示,骨髓基质细胞外泌体(BMSC-Exos)可以通过血管向骨髓运输,激活旁分泌途径使干细胞从静止状态向激活状态转变,进而向骨缺损区域募集。但是BMSCs-Exos因其本身容易被清除、半衰期短的问题,通常难以在体内存留至骨血管新生期。因此,骨缺损的外泌体治疗迫切需要一种时空控制释放的递送策略,以响应血管生成的时间和部位,促进干细胞募集并加速骨愈合。
近日,南方医科大学第三附属医院黄文华教授、利时雨博士后、孙永建主任团队开发了一种基于自组装肽水凝胶微球的酶响应递送材料,用于促进外泌体在骨血管新生期发挥的干细胞募集作用,相关研究以“Injectable MMP1-sensitive microspheres with spatiotemporally controlled exosome release promote neovascularized bone healing”为题发表在Acta Biomaterialia上。南方医科大学第三附属医院广东省医学3D打印生物医学创新平台黄文华教授、南方医科大学第三附属医院广东省医学3D打印生物医学创新平台利时雨博士后、南方医科大学儿童骨科孙永建主任为文章通讯作者;南方医科大学第三附属医院广东省医学3D打印生物医学创新平台杨洋博士后、南方医科大学第三附属医院广东省医学3D打印生物医学创新平台郑蔚晗硕士、南方医科大学儿童骨科谭为医生、上海交通大学医学院仁济医院泌尿外科伍笑棋博士为文章共同第一作者。
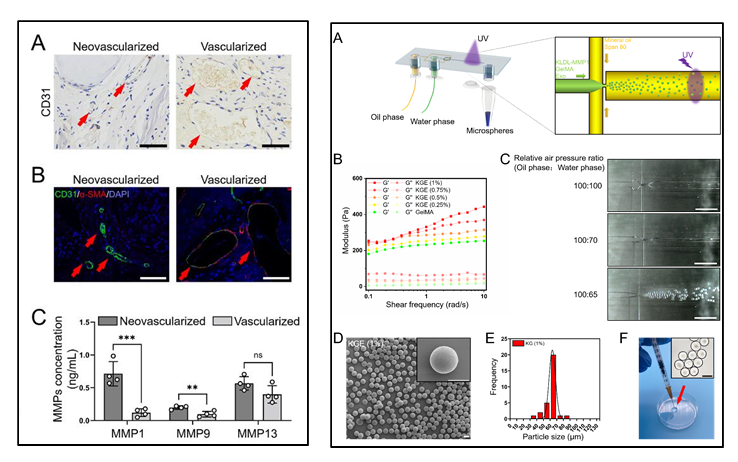
研究发现骨组织的新生血管周围特异性表达MMPs,为控制释放外泌体提供了一些潜在的酶响应策略。进一步,研究团队向KLDL-12自组装肽中添加MMP1底物序列,形成了MMP1酶敏感水凝胶材料(KLDL-MMP1),并将该KLDL-MMP1与GelMA、BMSC-Exos混合,通过微流控芯片制备形成可供微创注射的外泌体缓释微球(KGE)。
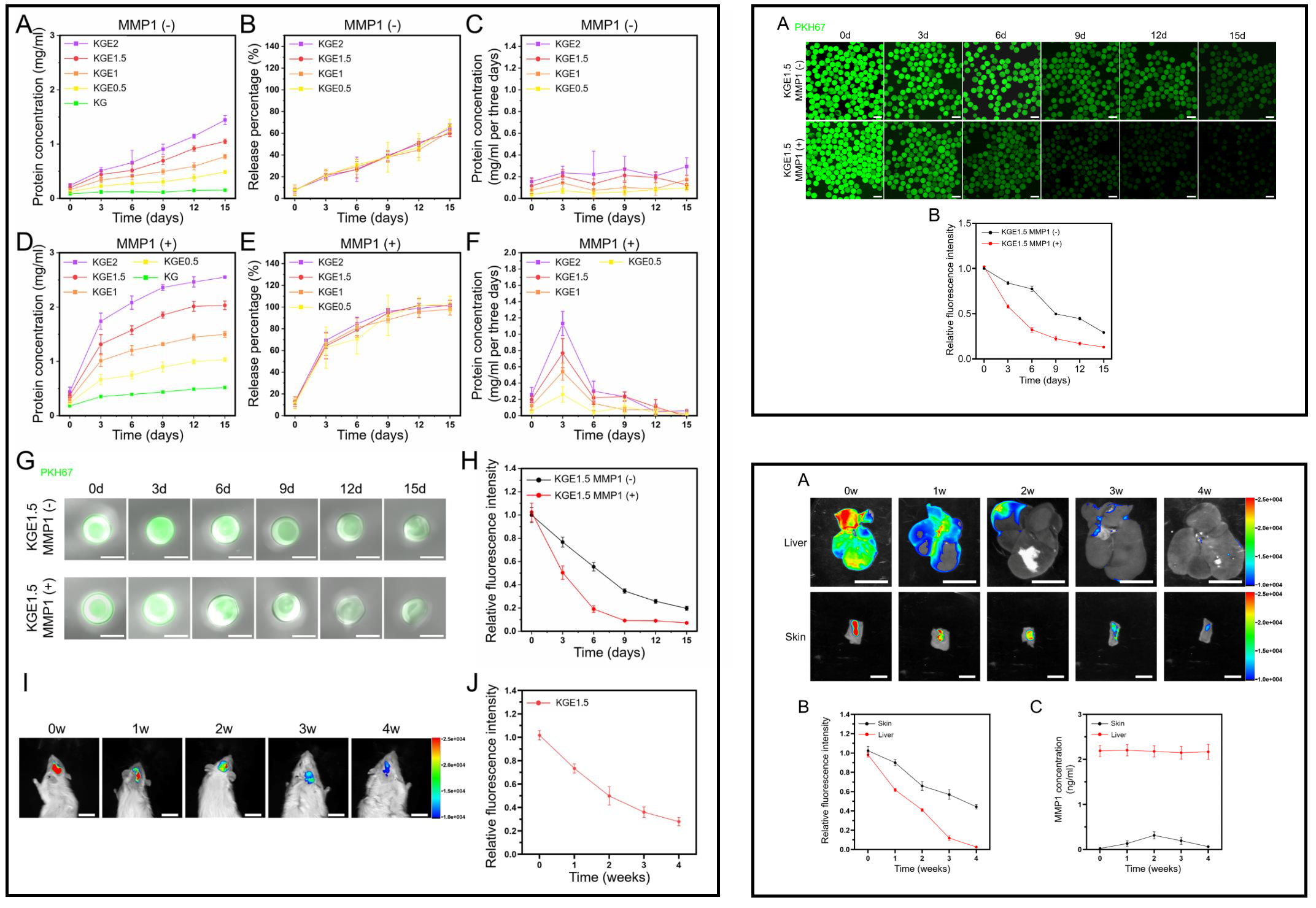
KGE微球在体内外实验中均表现出稳定的外泌体缓释速率,以及受MMP1浓度调控的响应性释放。在0.7 ng/mL的MMP1作用下(骨组织新生血管周围的生理浓度),KGE可在体外持续缓释外泌体超过15天;而在体内则可持续超过4周。说明KLDL-MMP1发挥了酶敏感释放作用,KGE微球可作为一种理想的外泌体递送材料。
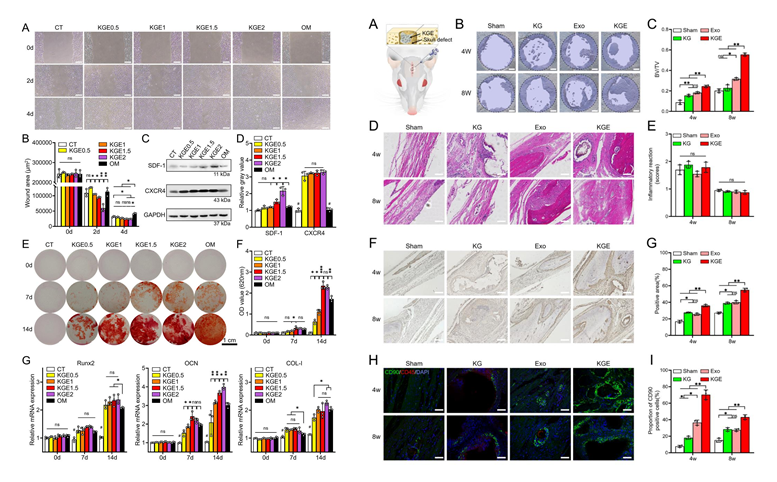
进一步通过将KGE微球与BMSCs共培养,发现KGE显著促进了细胞迁移以及干细胞募集相关蛋白SDF-1、CXCR4的表达,并且显著促进了细胞的成骨分化水平。在SD大鼠颅骨缺损修复的体内实验中,KGE有效促进了新骨组织再生,KGE周围大量募集了CD90+的干细胞。证明KGE确切增强了外泌体经新生血管招募干细胞的能力,且该策略有效加速了骨愈合过程。
参考文献:
Injectable MMP1-sensitive microspheres with spatiotemporally controlled exosome release promote neovascularized bone healing. Acta Biomater. 2022 Dec 5:S1742-7061(22)00800-5. doi: 10.1016/j.actbio.2022.11.065. Online ahead of print. PMID: 36481504
外泌体资讯网 Acta Biomater|南方医科大学三附院黄文华/利时雨/孙永建:可注射酶敏感微球时空释放外泌体以增强血管新生相关骨愈合