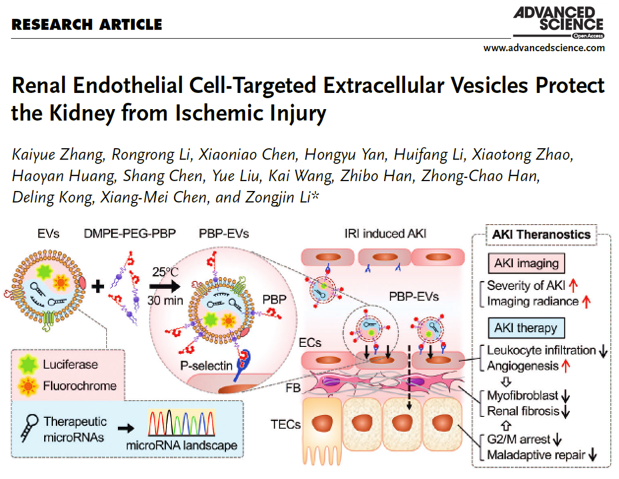
急性肾损伤是一种由于肾脏血流灌注不足、尿路梗阻以及由多种原因直接导致的肾实质损伤而造成的急性肾功能损害,其发病率在全球范围内不断上升,但目前临床上仍没有有效的靶向治疗手段。近日,南开大学李宗金教授团队在Wiley旗下Advanced Science杂志发表题为“Renal Endothelial Cell-Targeted Extracellular Vesicles Protect the Kidney from Ischemic Injury”的研究型论文,报道了一种特异性靶向损伤内皮细胞的工程化细胞外囊泡,及其在诊断、治疗急性肾损伤损伤中的应用[1]。与未修饰的细胞外囊泡相比,这种工程化细胞外囊泡可以将其携带的治疗性功能分子靶向递送至缺血再灌注损伤的肾脏,并通过其携带的荧光成像分子指示肾脏损伤程度,实现急性肾损伤早期诊断及靶向治疗一体化。
在该研究中,作者首先对P-选择素是否可以作为诊断急性肾损伤(AKI)的指标和靶向损伤肾脏递送细胞外囊泡(EVs)的靶点进行探究,结果表明,随着肾损伤程度的增加及损伤时间的延长,P-选择素在损伤肾脏肾小球及间质毛细血管中的表达量逐渐增加,而在正常肾脏中几乎没有表达。因此,作者选用P-选择素作为AKI早期诊断的指标和靶向治疗的靶点。
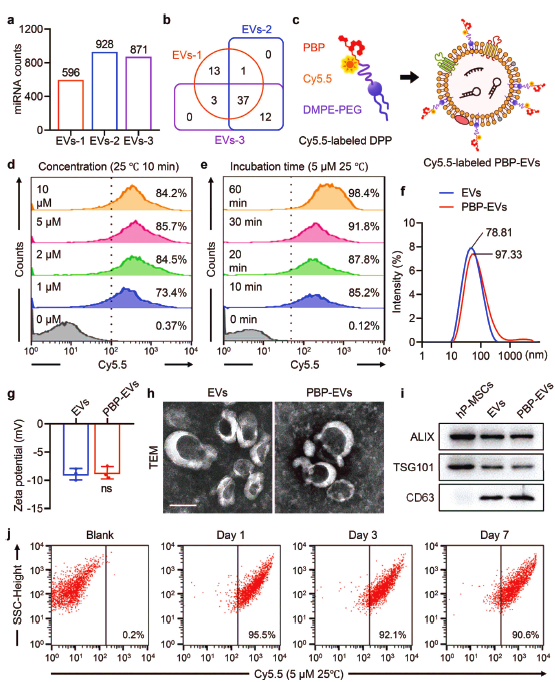
图1 | 内皮细胞靶向细胞外囊泡的制备及表征。(a-b) 人胎盘间充质干细胞分泌的细胞外囊泡中的microRNAs分析。(c) P-选择素靶向肽修饰细胞外囊泡的示意图。(d) P-选择素靶向肽修饰细胞外囊泡的条件优化。(f-i) 天然及P-选择素靶向肽修饰后的细胞外囊泡表征(粒径,zeta电位,扫描电镜形态,外泌体标志蛋白)。
在前期研究中,作者已经发现人胎盘来源的间充质干细胞(hP-MSC)分泌的EVs具有肾脏保护作用[2],同时对来自3位不同供体细胞EVs的microRNAs测序分析显示,EVs中携带了大量的具有促进血管新生、组织再生,抑制细胞凋亡及纤维化的功能型microRNAs。在此基础上,作者通过两亲性化合物DMPE-PEG将P选择素结合肽(PBP)修饰在hP-MSC来源的EV膜表面,设计了P-选择素结合肽(PBP)修饰的工程化EVs(PBP-EVs)。同时,作者利用Gaussia荧光素酶(Gluc)及Cy5.5荧光基团标记PBP-EVs,通过生物发光成像及荧光成像实现对PBP-EVs的活体示踪,从而将基于PBP-EVs的AKI早期诊断与靶向治疗进行整合,进行AKI诊疗一体化研究。经过条件优化,作者通过室温将EVs与DMPE-PEG-PBP共孵育30分钟,得到了稳定的PBP-EVs,其修饰效率在90%以上,且该修饰并未改变EVs本身的生物学特性。(图1)
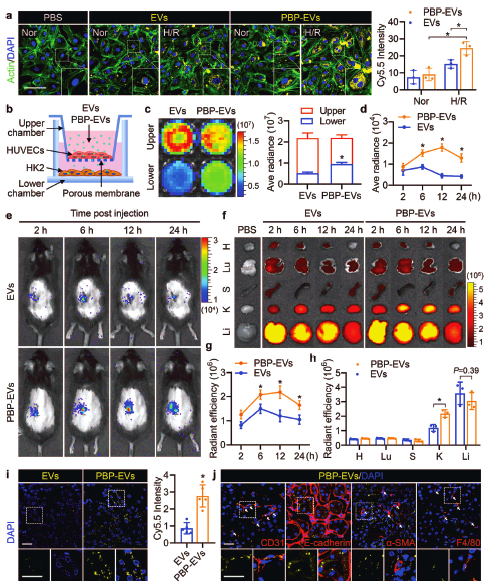
图2 | P-选择素靶向肽修饰的细胞外囊泡在体外及体内靶向损伤内皮细胞。(a) P-选择素靶向肽修饰的细胞外囊泡在体外靶向缺氧/复氧损伤的内皮细胞。(b-c) 在体外模型中,P-选择素靶向肽修饰的细胞外囊泡可以高效穿过内皮屏障并被上皮细胞吞噬内化。(d-h) 在缺血再灌注导致的急性肾损伤小鼠模型中,P-选择素靶向肽修饰的细胞外囊泡具有显著的损伤肾脏靶向特性,并在损伤肾脏中富集。(i-j)肾脏组织切片染色表明,P-选择素靶向肽修饰的细胞外囊泡主要富集在损伤肾脏的内皮细胞(CD31+)及小管上皮细胞(E-cadherin+)中。
随后,作者利用多种分子影像学技术手段,分别在体外和体内对PBP-EVs靶向损伤内皮细胞和损伤肾脏的能力进行了研究。结果显示,PBP-EVs对缺氧/复氧损伤的内皮细胞具有靶向性;并且在体外模拟内皮屏障模型中,PBP-EVs可以高效穿过损伤内皮屏障,被肾小管上皮细胞吞噬内化。与体外实验结果相似,PBP-EVs在小鼠AKI模型中也显示出良好的损伤肾脏靶向作用,生物发光成像及荧光成像结果均表明,PBP-EVs特异性富集在损伤肾脏中;免疫荧光染色结果显示,PBP-EVs主要累积在损伤肾脏中的血管内皮细胞及肾小管上皮细胞中。(图2)
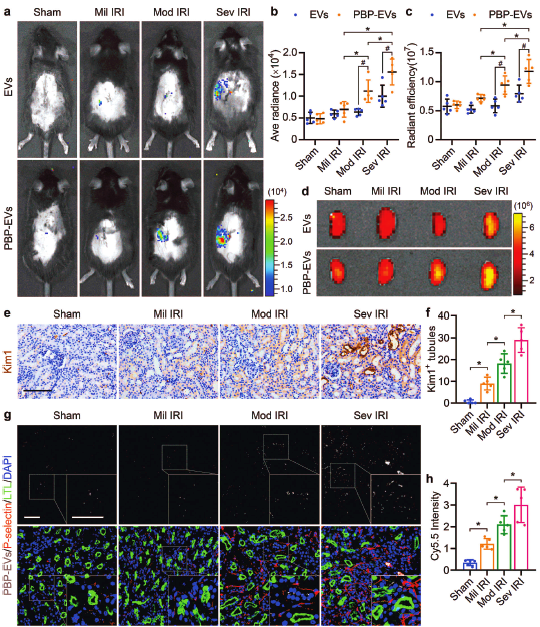
图3 | P-选择素靶向肽修饰的细胞外囊泡可用于指示肾损伤程度。(a-f) P-选择素靶向肽修饰的细胞外囊泡,可通过其携带的荧光素酶及Cy5.5荧光分子指示肾脏损伤程度。(g-h) 肾组织P-选择素免疫荧光染色图片显示,P-选择素靶向肽修饰的细胞外囊泡指示肾损伤程度是依赖于表达量随损伤程度严重而升高的P-选择素。
此外,作者还利用Gluc生物发光成像在活体小鼠内实时示踪PBP-EVs,对PBP-EVs用于早期诊断肾脏损伤程度的可能性进行探讨。Gluc成像结果显示,随着肾脏损伤程度的加重,PBP-EVs在损伤肾脏中的累积量增加,并释放出与损伤程度呈正相关的Gluc信号;而EVs注射组中,仅有重度肾损伤小鼠损伤肾脏区域出现Gluc信号增强。这些结果表明,通过在PBP-EVs上负载成像基团,即可实现通过检测累积在损伤肾脏内PBP-EVs的信号强度来判断肾脏损伤程度,为早期诊断急性肾损伤提供参考指标。Cy5.5荧光成像及损伤肾脏Kim1免疫组化染色结果进一步验证了通过PBP-EVs信号强度判断肾脏损伤程度的准确性。上述组织切片P-选择素免疫荧光染色的结果表明,PBP-EVs指示肾脏损伤程度是通过量化损伤肾脏内P-选择素的表达量来实现的。(图3)
同时,作者也对PBP-EVs的肾脏保护作用进行了深入研究。作者发现PBP-EVs可以改善损伤内皮细胞功能障碍,减少损伤肾脏内炎症细胞粘附浸润,并促进损伤后肾内修复性血管新生;同时PBP-EVs可以改善损伤小管上皮细胞G2/M期细胞周期阻滞,促进损伤小管上皮细胞增殖、减少小管上皮细胞损伤凋亡造成的促纤维化因子分泌;最终PBP-EVs治疗改善了损伤肾脏内的促纤维化微环境,抑制了损伤肾脏内肌成纤维细胞激活及胶原沉积,抑制肾纤维化,进而预防AKI向慢性肾病转化。
综上所述,该研究验证了P-选择素作为AKI早期诊断标志和靶向治疗靶点的潜力,并设计合成了可以在实现早期诊断AKI的同时对AKI进行靶向治疗的工程化EVs,提出了AKI诊疗一体化的研究策略,填补了AKI早期诊断和靶向治疗的空白,并为后续的AKI靶向治疗研究提供了潜在的药物递送载体,为EVs治疗AKI的临床转化提供了有现实意义的新思路。
南开大学博士研究生张凯悦为本文第一作者,李宗金教授为本文通讯作者;该工作由肾脏病学专家、中国工程院院士陈香美教授指导,获得了国家重点研发计划“干细胞及转化研究”重点专项支持(No. 2017YFA0103200)。
参考文献:
- Zhang, K., et al., Renal Endothelial Cell-Targeted Extracellular Vesicles Protect the Kidney from Ischemic Injury. Adv Sci (Weinh), 2022: p. e2204626.
- Zhang, K., et al., In vivo two-photon microscopy reveals the contribution of Sox9(+) cell to kidney regeneration in a mouse model with extracellular vesicle treatment.J Biol Chem, 2020. 295(34): p. 12203-12213.