动脉粥样硬化发展进程十分复杂,各阶段的斑块结构、细胞成分和病理特点各不相同。胞葬障碍是其病理变化特点之一。胞葬作用主要负责安全移除凋亡细胞,防止组织内容物释放,损害周围组织。早期斑块可进行有效胞葬,中晚期胞葬作用逐渐失效,无法及时清除凋亡细胞,导致斑块炎症消退失效,引起次级坏死,坏死核心变大。通过增强斑块胞葬作用,如药物注射CD47封闭抗体或间充质干细胞,可缓解动脉粥样硬化进展。而血管支架新生内膜增生厚度与原生斑块病理特点(如胞葬障碍)联系密切,血管支架应用所面临的支架内再狭窄临床问题可能与原生斑块胞葬障碍相关。 近期,西南交通大学材料科学与工程学院黄楠/杨苹/赵安莎课题组在ACS NANO发表了题为“Exosome-Loaded Pro-efferocytic Vascular Stent with Lp-PLA 2 -Triggered Release for Preventing In-Stent Restenosis”的研究论文(doi.org/10.1021/acsnano.2c05847)。该论文发现了间充质干细胞外泌体对巨噬细胞胞葬障碍的修复功能,揭示了其作用机制,并针对预防血管支架再狭窄发生提出胞葬干预策略。西南交通大学材料科学与工程学院博士研究生邹丹为第一作者,西南交通大学材料科学与工程学院杨苹教授为该研究通讯作者。该研究受到国家自然科学基金和西南交通大学材料先进技术教育部重点实验室的支持。
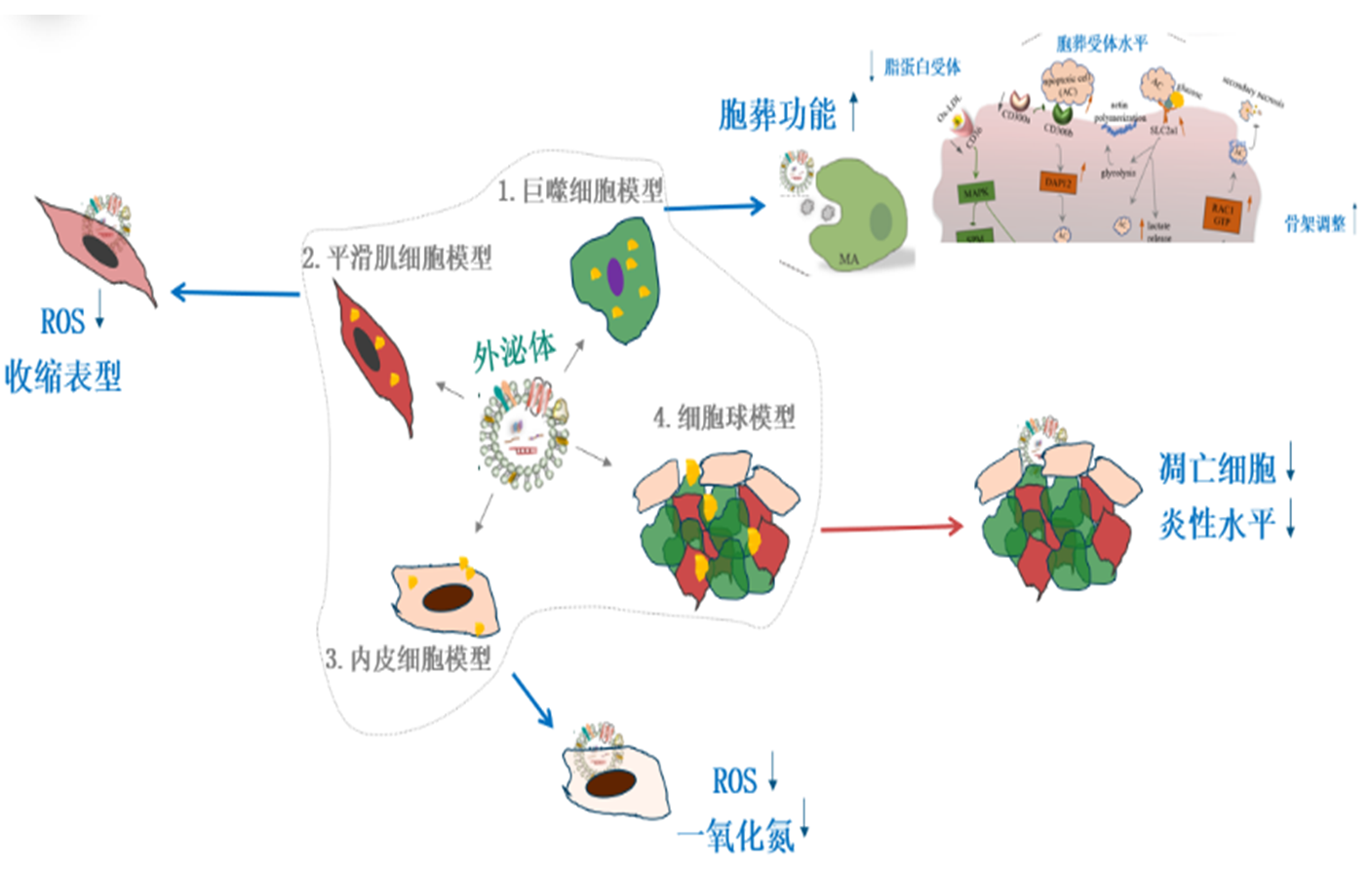
该研究首先发现了间充质干细胞外泌体的内涵蛋白和miRNA涉及胞葬作用、脂质代谢、细胞塑性和氧化等重要生物过程。后基于巨噬、平滑肌、内皮细胞评估模型,揭示了间充质干细胞外泌体主要通过上调胞葬受体分子SLC2a1和骨架调节分子STAT3/RAC1,抑制胞葬受体竞争分子CD300a表达,改善巨噬细胞胞葬功能,并通过下调CD36水平缓解巨噬细胞泡沫分化过程。同时,间充质干细胞外泌体下调了平滑肌和内皮细胞的胞内ROS水平,并促进了平滑肌细胞收缩表型转换。在细胞球模型评估中,印证了间充质干细胞外泌体改善巨噬细胞对凋亡细胞的清除能力。图 1 间充质干细胞外泌体调控巨噬细胞、平滑肌细胞和内皮细胞功能示意图图2 载外泌体生物响应血管支架的制备示意图及其作用机理图
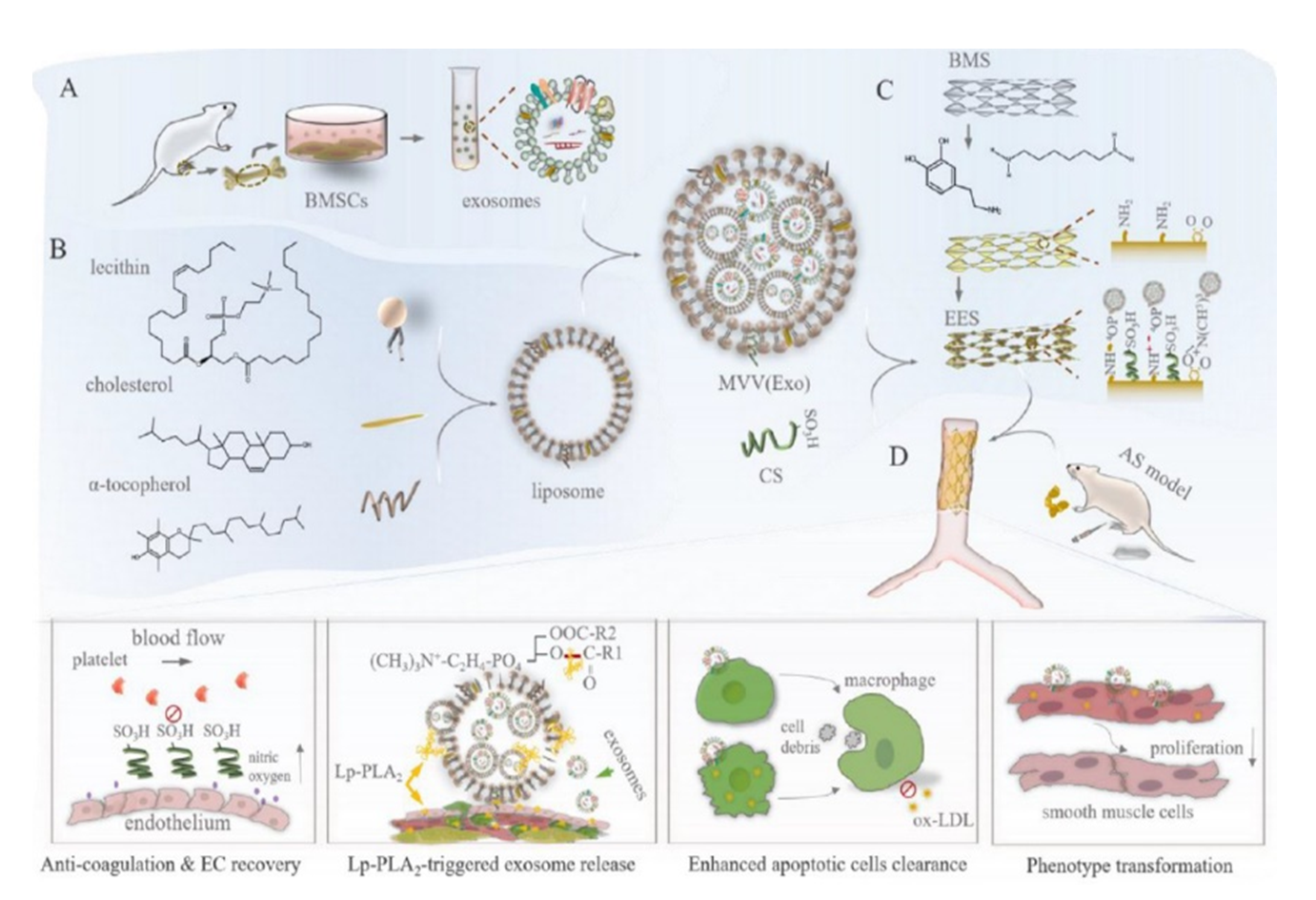
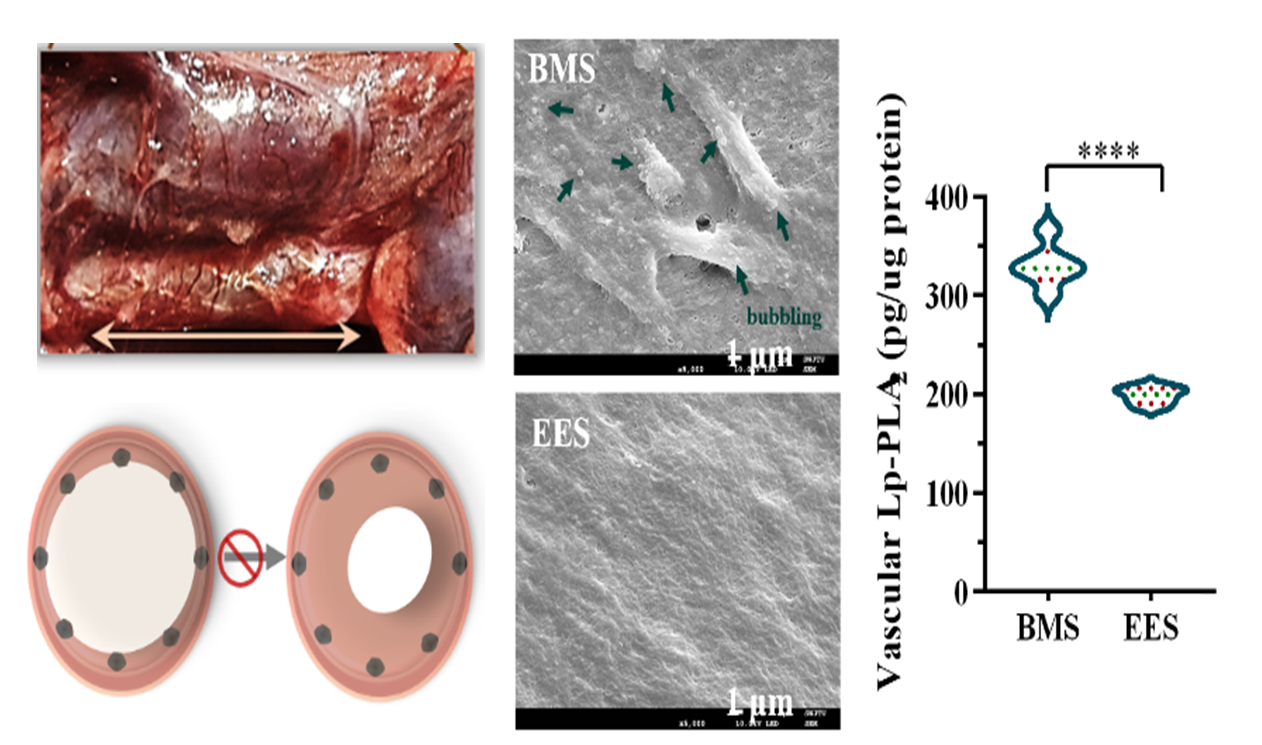
有鉴于此,作者基于心血管风险因子Lp-PLA2开展了载体生物响应设计,利用多腔室脂质体包载外泌体,并制备了载外泌体多囊泡生物响应涂层,用于血管支架表面改性。该涂层具有磷脂酶A2响应特性,实现了外泌体的可控释放,并显著改善了基底表面的生物相容性。在动脉粥样硬化大鼠模型中,外泌体改性血管支架显著改善了裸支架表面新生组织的焦亡状态,同时下调了病理血管的心血管风险因子Lp-PLA2水平,充分表明,外泌体减弱了原生斑块对支架植入后内膜修复的影响,有效预防了血管支架内再狭窄的发生。该研究为利用外泌体修复原生病灶胞葬功能障碍的血管支架表面工程新策略提供了重要的技术积累。图 3 外泌体支架植入图和SEM形貌及Lp-PLA2水平统计图
Exosome-Loaded Pro-efferocytic Vascular Stent with Lp-PLA2-Triggered Release for Preventing In-Stent Restenosis, ACS Nano. 2022 Sep 27;16(9):14925-14941. doi: 10.1021/acsnano.2c05847. Epub 2022 Sep 6.外泌体资讯网 ACS NANO| 西南交通大学黄楠/杨苹/赵安莎团队:针对血管支架内再狭窄问题,提出了基于间充质干细胞外泌体的胞葬干预策略