随着年龄的增长,心肌梗死、心力衰竭等心血管疾病的发生率增加。在衰老过程中,越来越多的细胞经历永久的生长停滞。衰老细胞的积累最终导致组织损伤和衰老相关疾病。然而,由于缺乏模拟人类衰老过程的合适动物模型,导致衰老的分子机制在很大程度上仍然未知。目前尚无预防或延缓心脏衰老的有效治疗方法。10月31日,苏州大学心血管病研究所的李杨欣教授团队在生物医学1区杂志《Theranostics》(IF=11.6)期刊上发表了一项新研究。他们成功构建了用于衰老研究的心肌细胞特异性敲除的KO和CKO小鼠,并发现circHIPK3的缺失导致心肌细胞衰老加剧和心功能下降。circHIPK3可发挥分子粘合剂的作用,增强E3泛素连接酶β-TrCP与细胞质中HuR的结合,导致HuR泛素化降解,降低p21活性。间充质干细胞来源的外泌体(UMSC-Exos)通过传递circHIPK3发挥抗衰老和心脏保护作用。该研究揭示了干细胞外泌体抗心肌细胞衰老的新机制。
在这项研究中,研究人员利用RNA测序(RNA-seq)比较了年轻鼠和衰老鼠心脏的circRNA表达,发现一种高度保守的circRNA——circHIPK3,表现出了显著差异,其在年轻鼠心脏中的表达显著高于衰老鼠,接着他们比较了小鼠心脏、肝脏、脾脏、肺和肾脏组织中circHIPK3的表达,发现circHIPK3的表达在心脏中表达最为丰富,并发现circHIPK3在心脏中的表达水平随着年龄的增长而下降,从而确定了circHIPK3在心脏衰老过程中发挥着重要的作用。为了进一步确定circHIPK3是否影响心肌细胞的衰老,研究人员构建circHIPK3的过表达质粒,他们发现当过表达circHIPK3后能够显著降低心肌细胞的相关衰老指标的水平,而抑制circHIPK3则会促进心肌细胞的衰老。为了证实circHIPK3在心脏衰老中的作用,研究人员构建了心肌细胞特异性的circHIPK3敲除鼠(KO鼠和CKO鼠),结果表明circHIPK3缺失会导致心脏早期衰老和心功能障碍。为了证实circHIPK3在心脏衰老中的保护作用,他们在CKO小鼠中注射过表达的慢病毒(LV-circHIPK3)。LV-circHIPK3改善了CKO心功能。这些结果表明,心肌细胞中circHIPK3的缺失导致小鼠心脏衰老和生存能力变差。为了了解为什么circHIPK3的缺失会导致衰老标志物p21的上调,研究人员首先通过生物信息学技术分析了circHIPK3可能的靶蛋白。结果显示p21并不是circHIPK3的靶点,但HuR与circHIPK3之间存在结合位点,而HuR能够通过调节SIRT1、细胞周期相关蛋白和端粒长度直接参与衰老过程,有趣的是HuR能够与p21 mRNA 3'-UTR区域的ARE结合,以增加其稳定性,最终导致p21蛋白在细胞质中的表达增强。既往研究表明,HuR主要位于细胞核内,但在缺血、缺氧和紫外线照射下可转位到细胞质中。因此,研究人员推测circHIPK3通过抑制HuR向细胞质的易位或增加其降解,从而导致p21 mRNA的不稳定来防止衰老。为了验证这一假设,研究人员分别在组织和细胞水平进行了功能获得和缺失验证,结果表明circHIPK3缺失不影响HuR mRNA的水平,但HuR蛋白水平显著上调。此外免疫荧光结果证明沉默心肌细胞的circHIPK3后,H9C2细胞的细胞质中HuR显著增加。这些结果表明,circHIPK3可以决定HuR的定位,并在转录后水平调控HuR的表达。此外,他们利用RNA-pull - down-Western blot技术检测了circHIPK3和HuR之间的物理联系,RIP实验和qRT-PCR均表明circHIPK3可能通过直接相互作用调节HuR稳定性。接着,研究人员发现HuR和E3泛素连接酶β-TrCP之间存在相互作用,为了进一步确定circHIPK3诱导HuR蛋白下调是否由泛素-蛋白酶体系统介导。他们首先使用特异性蛋白酶体抑制剂MG132处理细胞,证明了HuR是通过蛋白酶体途径降解。RIP实验证实circHIPK3与泛素连接酶β-TrCP之间存在直接相互作用,Co-IP表明circHIPK3沉默减弱了HuR与β-TrCP之间的相互作用,减少了HuR的泛素化。沉默circHIPK3增强了HuR蛋白与p21 mRNA之间的相互作用,而HuR沉默逆转了circHIPK3 siRNA对p21表达的影响,表明circHIPK3通过调节HuR抑制p21水平。这些结果表明,circHIPK3增强了HuR和β-TrCP的相互作用,通过泛素-蛋白酶体途径降解HuR,HuR的降解降低p21的稳定性,导致p21表达降低。该研究揭示了circHIPK3在心肌细胞衰老过程中的分子机制。重要的是,UMSC-Exos可以补充心脏衰老过程中circHIPK3的丢失,改善了CKO小鼠的心功能。研究人员表示,他们构建的两种研究心脏特异性发育的新型circRNA敲除模型,其中circHIPK3 KO小鼠为先天性心脏病提供了一种新的潜在模型,而可诱导的circHIPK3 CKO小鼠是一种有前途的衰老性心功能障碍模型。此外,他们发现UMSC-Exos通过释放circHIPK3来防止心肌细胞衰老并改善心功能,这在治疗衰老引起的心功能障碍方面具有临床意义。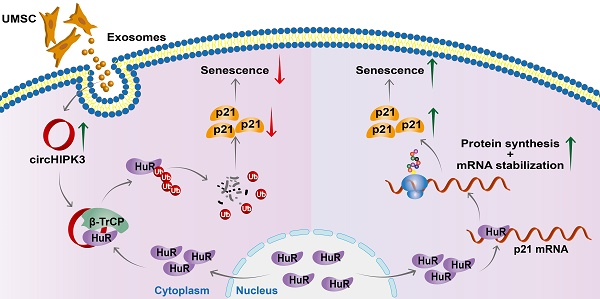
苏州大学心血管病研究所的李杨欣教授为文章的通讯作者,课题组博士生丁凤枝、硕士生陆琳和吴诚洁为文章的并列第一作者。Ding F, Lu L, Wu C, Pan X, Liu B, Zhang Y, Wang Y, Wu W, Yan B, Zhang Y, Yu XY, Li Y. circHIPK3 prevents cardiac senescence by acting as a scaffold to recruit ubiquitin ligase to degrade HuR. Theranostics 2022; 12(17):7550-7566.原文链接:https://www.thno.org/v12p7550.htm外泌体资讯网 苏州大学李杨欣教授团队揭示外泌体中circHIPK3通过作为分子粘合剂招募泛素连接酶降解HuR来防止心脏衰老

