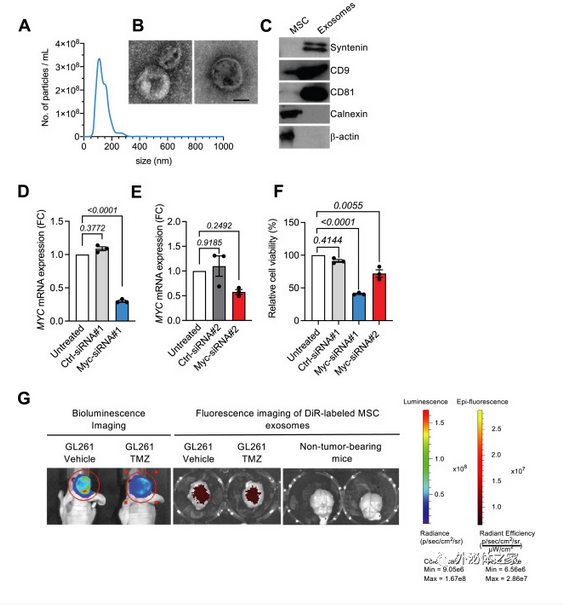
Myc信号异常是包括多形性胶质母细胞瘤(GBM)等肿瘤类型的关键致癌途径,尽管科学界对Myc的致癌机理及抑制方案研究很多,然而目前仍然缺乏有效的Myc靶向治疗方法。来自德克萨斯大学MD Anderson癌症中心Raghu Kalluri教授课题组的研究人员使用工程化的骨髓间充质干细胞(MSC)外泌体,用于传递靶向Myc基因的siRNA,在GBM小鼠肿瘤模型中得到了良好的抑制效应。相关研究以“Engineered exosomes targeting MYC reverse the proneural-mesenchymal transition and extend survival of glioblastoma”为题发表于新一期的Extracellular Vesicle杂志上。
图:携带siRNA的MSC外泌体有效靶向Myc和小鼠GBM肿瘤。
多形性胶质母细胞瘤(GBM)恶性程度高,超过三分之二的GBM的患者两年内会死亡。大脑和肿瘤独特的生物学和微环境使GBM治疗具有挑战,这是由于血脑屏障(BBB)的作用,阻碍了有效的抗癌治疗。此外,GBM相关的肿瘤内异质性和细胞可塑性可能导致耐药发生。
人类GBM肿瘤中有两种主要的癌细胞亚群:间充质和前神经细胞。在GBM肿瘤中,这两种细胞类型共存,可能存在间充质和前神经基因标记之间的动态转变。包括基因突变、表观遗传改变、缺氧、炎症、免疫细胞的招募、化疗和放疗都会造成这种转变。与前神经特征相比,间质特征更表现出治疗耐药和较差的预后。
GBM肿瘤被认为是由具有自我更新和分化能力的神经干细胞产生的。Myc通路驱动神经干细胞增殖和更新,在发育中的大脑中产生不同的神经和胶质细胞群。Myc也是在干细胞驱动的GBM中最普遍的去调控基因之一。在GBM中,Myc过表达是GBM进展和维持所必需的,一些临床前研究表明,当Myc或其上游或下游靶点被抑制时,肿瘤会消退。Myc作为一种高度保守的核转录因子,事实上在大多数人类癌症中都异常表达。除了驱动和维持肿瘤形成外,Myc对于正常细胞和一些再生组织的组织内稳态也是必不可少的。但是,在正常细胞中,Myc mRNA寿命很短;而肿瘤细胞显示出持续的Myc转录,Myc mRNA转录本的半衰期会延长。
尽管大量证据表明靶向Myc具有治疗前景,人们一直在努力将靶向Myc方案进入临床转化,但到目前为止,Myc尚未在临床成功。靶向Myc被认为是“不能成药”的,因为它缺乏酶活性,传统的小分子药物只有在伴侣蛋白存在下才有抑制活性。封闭Myc活性的替代方法已经被广泛探索,包括Myc/Max复合体破坏、转录或翻译抑制等。然而,这些方法都没有在临床试验或测试中获得成功。
RNA干扰(RNAi)是一种高度特异性和多功能的抑制基因表达的技术,已成为小分子难以靶向的基因的选择。已经证实存在选择性和安全靶向肿瘤细胞中Myc mRNA的治疗窗口,但临床尝试使用RNAi靶向Myc mRNA,却由于药物稳定性差和传递问题而终止。近年来,通过脂基、有机和无机纳米颗粒传递Myc RNAi的研究已经展开。由于转染效率低、生产成本高、毒性和免疫原性高,这些方法的临床应用一直受到阻碍。
外泌体是平均直径100纳米的脂质双分子层,由所有活细胞自然释放,具有作为药物载体的广阔前景。外泌体是细胞间通讯网络的主要组成部分,在邻近细胞和远处细胞之间运送多肽、代谢物和核酸。各种小分子药物、化疗药物和RNAi已经成功装入外泌体,并在体外和临床前模型中传递到目标细胞,证明具有抗肿瘤的有效性。由人骨髓间充质干细胞/基质细胞(MSC)产生的外泌体,由于其强大的安全性和较低的免疫原性,已被开发为药物传递载体,目前正在一些临床试验中进行研究。
在这项研究里,Raghu Kalluri教授课题组的研究人员从MSCs细胞中获取外泌体,并用于装载靶向小鼠原位GBM肿瘤的Myc siRNA(iExo-Myc)。用iExo-Myc治疗晚期GBM肿瘤可抑制增殖和血管生成,抑制肿瘤生长,延长生存期。GBM的转录谱显示,间充质转变和雌激素受体信号通路受到Myc抑制的影响。单核RNA测序(snRNA-seq)显示,iExo-Myc治疗诱导多种生长因子和白介素信号通路的转录抑制,触发间充质向神经前质的转变,并改变肿瘤的细胞形态。这些数据证实Myc是一种有效的抗胶质瘤靶点,而iExo-Myc提供了一种可行的、易于转化的策略来抑制Myc这个高难度靶点,用于GBM的治疗。
参考文献: Engineered exosomes targeting MYC reverse the proneural-mesenchymal transition and extend survival of glioblastoma. Extracellular Vesicle. 2022 Dec, 1: 100014.
外泌体资讯网 Extracellular Vesicle丨Kalluri团队开发了新的靶向MYC的工程外泌体用于胶质瘤治疗