癌症是一个全球性的公共健康问题,已成为当今世界上死亡率最高的常见病及多发病之一。相比于传统的癌症治疗手段,肿瘤疫苗能通过激活机体自身抗肿瘤免疫反应达到预防和治疗肿瘤的目的。然而,肿瘤自身及其微环境中存在多重免疫抑制机制,使得肿瘤细胞在各种免疫逃逸通路作用下,摆脱免疫系统的监视及免疫杀伤作用,严重限制肿瘤疫苗的治疗效果。如何开发新型肿瘤疫苗,克服单一肿瘤疫苗难以原位激活T细胞,治疗效率低等缺点对于肿瘤的根治具有重要的研究意义。因此,通过创新设计合理的联合肿瘤免疫治疗是有望改善治疗效果的有效途径。
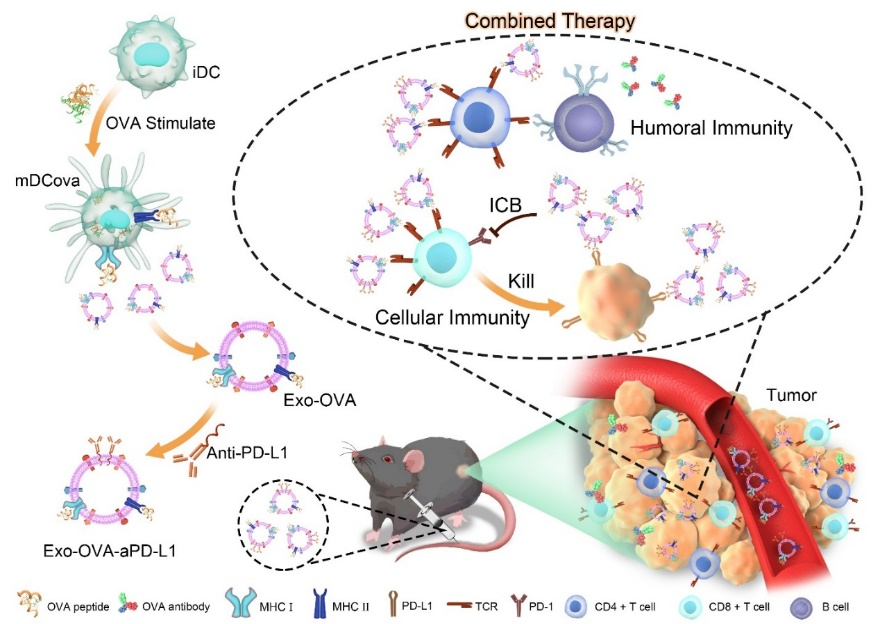
基于上述问题,南方医科大学附属东莞医院李振华研究员与河北大学张金超教授团队构建了兼具T细胞激活和抑制免疫逃逸作用的工程化外泌体疫苗。该体系中,合作团队首先提取了抗原饲养的树突细胞(DCs)衍生的外泌体疫苗并证明其可通过外泌体表面携带的CD80和MHC等共刺激因子原位激活T细胞。更重要的是,为了阻断肿瘤免疫逃逸,将抗PD-L1抗体(aPD-L1)武装在外泌体疫苗表面,同时实现阻断PD-1/PD-L1结合和激活抗原特异性T细胞,达到“一箭双雕”协同治疗肿瘤的目的。相关研究成果以“PD-L1 Antibodies-armed Exosomal Vaccine for Enhanced Cancer Immunotherapy by Simultaneously in situ Activating T cells and Blocking PD-1/PD-L1 Axis”为题,发表在国际权威学术期刊Extracellular Vesicle上 (1 (2022) 100012)
为获取工程化外泌体疫苗,研究人员首先分离了原代骨髓细胞(BMCs)并利用rmIL-4和rmGM-CSF诱导其分化为DCs。随后选取鸡卵清白蛋白(OVA)作为模式抗原并饲养DCs产生包含抗原的外泌体Exo-OVA。最后将获得的外泌体用aPD-L1武装起来,特异性阻断PD-L1/PD-1通路,增强原位T细胞的激活的同时防止免疫逃逸。体内外研究结果表明,Exo-OVA-aPD-L1成功地抑制了黑色素瘤的生长、复发和转移。
李振华研究员、刘会芳和张金超教授合作团队近期在利用免疫细胞来源的外泌体疫苗实现增强的免疫治疗方面发表了多篇工作(Biomaterials, 2022, 282, 121424;iScience 2022, 25, 103639; Acta Biomaterialia, 2022. DOI: 10.1016/j.actbio.2022.09.014)。该工作进一步拓展了工程化外泌体的应用,促进外泌体肿瘤疫苗的发展。硕士研究生戴欣悦、王钊铄为本文共同第一作者。该研究得到了国家自然科学基金(21977024、21601046和31971304)和广东省基础与应用基础研究基金(2021B1515120065)的资助。Extracellular Vesicle (Elsevier)是细胞外囊泡研究和转化领域杰出科学家美国北卡大学教堂山分校与北卡州立大学的程柯教授担任创刊主编,由美国细胞外囊泡协会 (AAEV)和爱思唯尔出版公司共同创办的一本主打细胞外囊泡相关研究的英文新刊,同时也是美国细胞外囊泡协会的官方期刊。期刊以细胞外囊泡为中心,聚焦细胞外囊泡相关基础研究、产业转化及临床应用三大研究领域,旨在打造为细胞外囊泡领域综合性顶级期刊。参考文献:
- 1. Xinyue Dai#, Zhaoshuo Wang#, Miao Fan, Huifang Liu, Xinjian Yang, Xueyi Wang, Xiaohan Zhou, Yunlu Dai, Jinchao Zhang*, Zhenhua Li*. PD-L1 antibodies-armed exosomal vaccine for enhanced cancer immunotherapy by simultaneously in situ activating T cells and blocking PD-1/PD-L1 axis. Extracellular Vesicle, 2022, 1, 100012.
- 2. Miao Fan, Huifang Liu, Hongyu Yan, Ruijun Che, Yi Jin, Xinjian Yang, Xiaohan Zhou, Hua Yang, Kun Ge, Xing-Jie Liang, Jinchao Zhang*, Zhenhua Li*. A CAR T-inspiring platform based on antibody-engineered exosomes from antigen-feeding dendritic cells for precise solid tumor therapy, Biomaterials, 2022, 282, 121424.
- 3. Gaoqian Zhao, Huifang Liu*, Zhaoshuo Wang, Hua Yang, Huiqing Zhao, Yixin Zhang, Kun Ge, Xueyi Wang, Li Luo, Xiaohan Zhou, Jinchao Zhang*, Zhenhua Li*. Exosome Transportation-mediated Immunosuppression Relief via Cascade Amplification for Enhanced Apoptotic Body Vaccination. Acta Biomaterialia, 2022. DOI: 10.1016/j.actbio.2022.09.014
- 4. Fangfang Lv, Huifang Liu*, Gaoqian Zhao, Erman Zhao, Hongyu Yan, Ruijun Che, Xinjian Yang, Xiaohan Zhou, Jinchao Zhang, Xing-Jie Liang*, Zhenhua Li*. Therapeutic exosomal vaccine for enhanced cancer immunotherapy by mediating tumor microenvironment. iScience 2022, 25, 103639.
外泌体资讯网 Extracellular Vesicle | 南方医科大学附属东莞医院李振华:具有“一箭双雕”作用的工程化外泌体疫苗




