帕金森病(Parkinson's disease,PD)是一种以黑质多巴胺能神经元选择性、渐进性大量变性缺失为主要病理改变的神经系统变性疾病,其主要病理特征之一是残存神经元中的嗜酸性包涵体——路易小体,主要由a-突触共核蛋白(a-Synuclein,a-Syn)组成。现有的所有药物及手术治疗手段均无法阻断疾病进展,已开展的针对PD患者神经保护药物的临床实验尚未得到阳性结果,主要原因之一即为干预时间太晚,错过了疾病代偿期。然而PD在我国仍处于就诊率低及诊断率低的现状,该疾病的早期诊断率持续偏低的原因不仅是由于疾病的隐袭起病及前驱期症状的多样性和不典型性,更是因为至今尚缺乏普遍存在的,便捷易得的,敏感的PD超早期临床诊断标记物。
PD的超早期阶段包括临床前期(病理学损害期)及帕金森病前驱期(prodromal PD,pPD),2019年帕金森病前驱期诊断研究标准中国专家共识中明确,pPD是指患者出现非运动症状,乃至轻微运动症状,但尚不符合PD临床诊断标准。这类患者未来10年内发生PD的风险明显高于平均值,从患者出现第一个PD非运动症状至符合PD临床诊断标准之间的前驱期阶段可长达20年,该时期无疑是一个关键的诊断时期,超早期疾病的确诊和治疗干预的时机把握是神经内科医师面临的首要问题。然而pPD患者常见的前驱期症状,例如抑郁、便秘、嗅觉障碍等缺乏典型性、特异性,无法由此准确判断患者是否会发展为PD,此时检测一项典型的生物学标志物则可成为可靠有效的诊断手段,但在现有技术中尚缺乏相关的pPD诊断生物标志物(Biomarker)。因此,亟需探索一种诊断pPD独立的可量化的Biomarker指标,这对于中老年人群中前驱期患者的筛查发现,PD的超早期诊断乃至对疾病的及时干预均具有重要的临床价值和社会价值。小胶质细胞不受控制的激活是PD发病的关键,可分泌Cathepsin L (CTSL)影响PD患者神经元的存活; 然而,精确的机制还有待确定。
2022年10月6日,同济大学徐俊教授团队和上海市第八人民医院陈旭教授团队在npj Parkinson’s Disease上发表了题为“Cathepsin L-containing exosomes from α-synuclein-activated microglia induce neurotoxicity through the P2X7 receptor”的文章(2022 Oct 6;8(1):127),阐明了由α-Syn激活的小胶质细胞通过外泌体增加CTSL的胞外释放,并介导P2X7受体诱导神经毒性这一机制。该文章的通讯作者为同济大学的徐俊教授、杨丹静博士和上海市第八人民医院的陈旭教授,第一作者为上海市第八人民医院的蒋天放博士,徐州医科大学附属医院的徐传英博士和同济大学的高山峨博士。

该团队前期研究首次证明CTSL主要由α-syn激活的小胶质细胞衍生的外泌体释放,导致神经元损伤和死亡。GW4869阻断了CTSL活性的升高,表明外泌体在介导CTSL释放中发挥了关键作用。此外,P2X7R/PI3K/AKT信号通路被确定为潜在的分子机制,因为该信号通路的特异性拮抗剂,P2X7R敲减和外泌体释放抑制剂显著降低了对培养的小鼠皮层神经元的损伤。在这篇文章中,作者发现α-syn激活的小胶质细胞通过外泌体增加CTSL的胞外释放,可放大和加重小胶质细胞的神经毒性作用,这意味着CTSL可能参与了PD发病的一种新的机制,并可能作为PD药物开发的潜在生物标志物和新靶点。
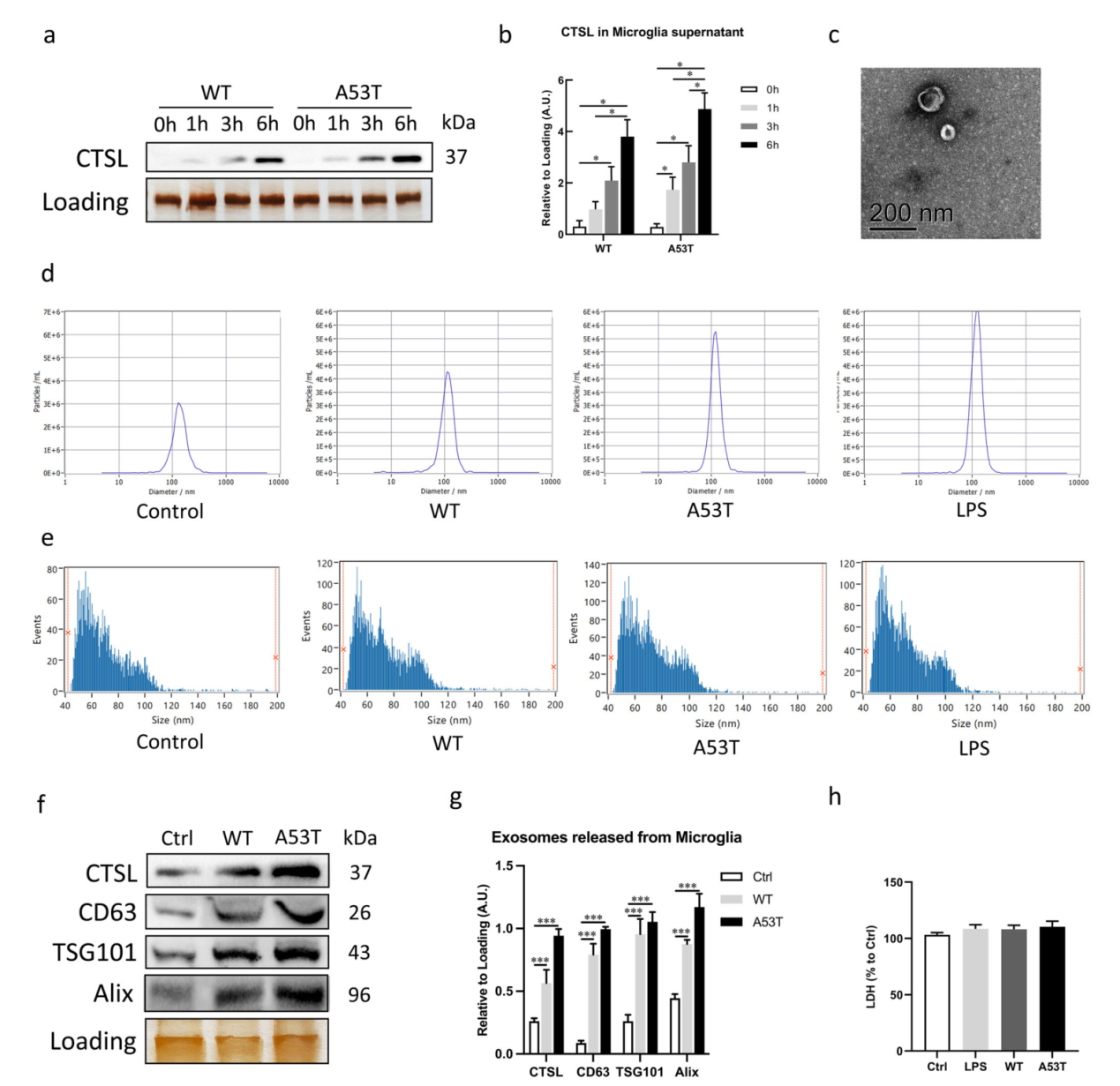
文章首先通过透射电镜、NTA和Western blot实验证实,在α-Syn寡聚物刺激下,小胶质细胞外泌体中携带的CTSL含量以时间依赖的方式升高。相同条件下,突变体A53T α-Syn寡聚物刺激更多CTSL释放(图一)。
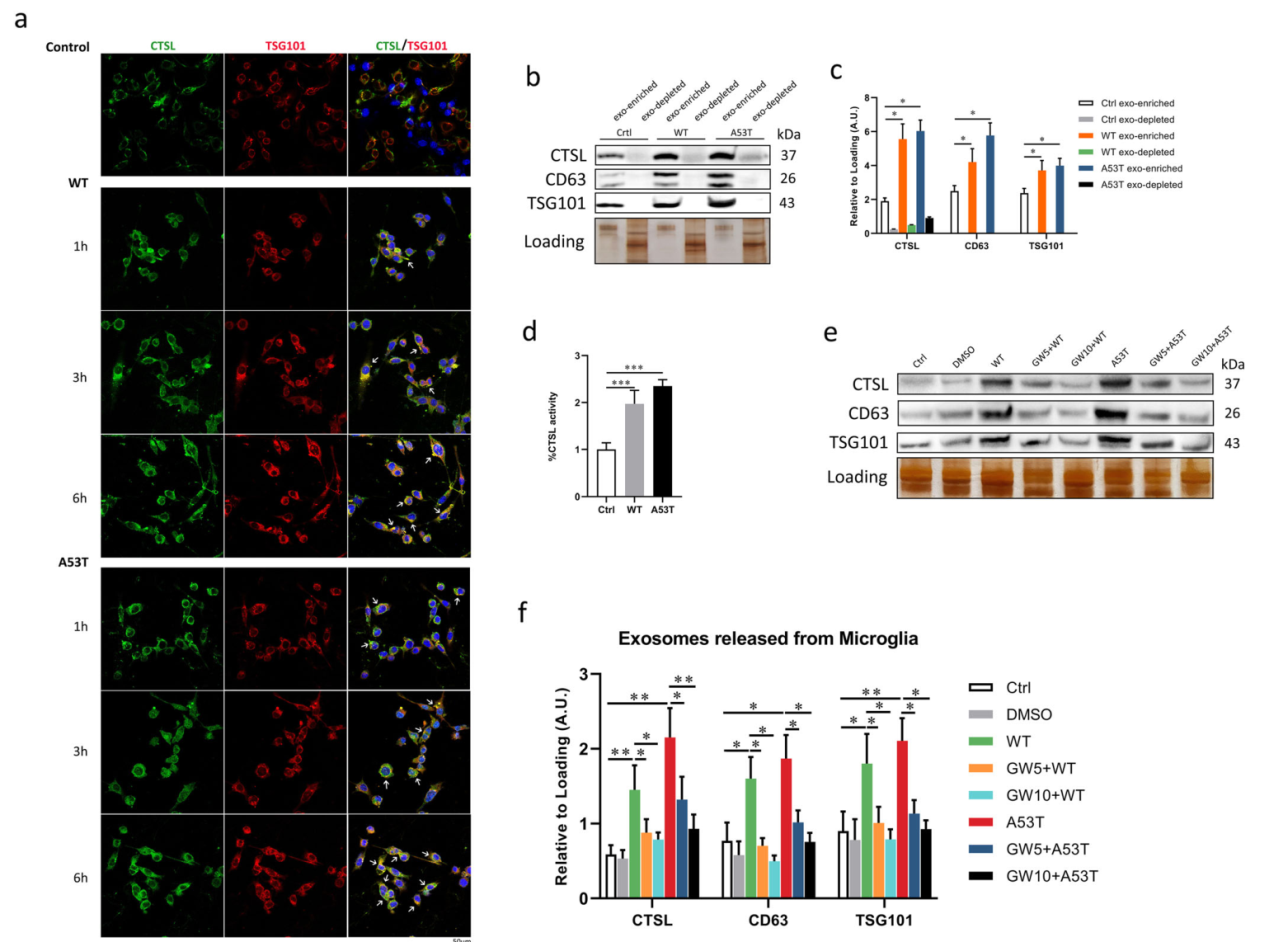
随后用外泌体抑制剂阻断小胶质细胞分泌外泌体,通过细胞荧光免疫染色和Western blot实验表明α-Syn寡聚体激活的CTSL释放的主要机制是外泌体介导的。(图二)
图二
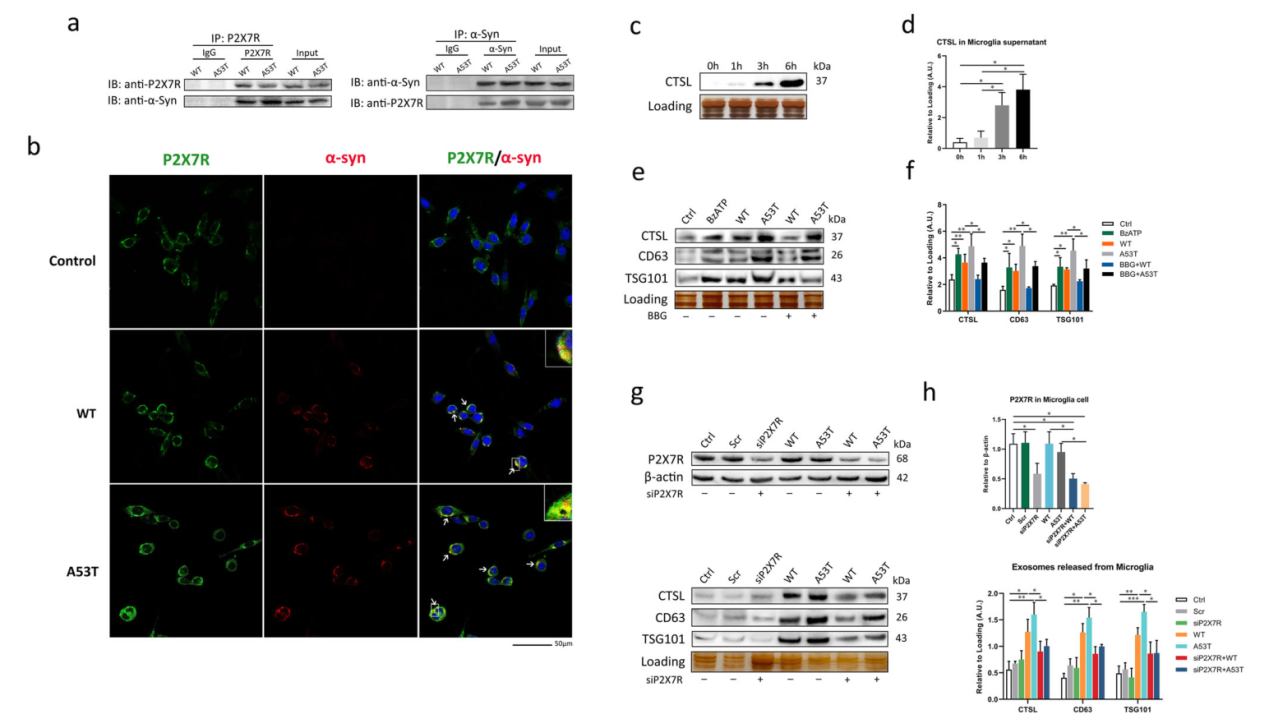
通过co-IP等实验表明,P2X7R对于从α-Syn寡聚物处理的小胶质细胞中释放含有CSTL的外泌体是必要的。WT和A53T α-Syn寡聚物与P2X7R共免疫沉淀,其中A53T α-Syn寡聚物表现出更强的相互作用。细胞免疫荧光染色实验发现α-Syn与P2X7R共定位。P2X7R激动剂BzATP明显诱导α-Syn寡聚物激活的小胶质细胞通过外泌体释放CTSL,而P2X7R拮抗剂BBG预处理可有效逆转CTSL的外泌体释放,用siRNA 敲除P2X7R也证实了这一现象。(图三)
图三
P2X7R通过细胞外α-Syn寡聚物刺激小胶质细胞中的PI3K/AKT信号,而α-Syn寡聚物通过P2X7R/PI3K/AKT信号通路激活小胶质细胞中含CTSL的外泌体释放。(图四)
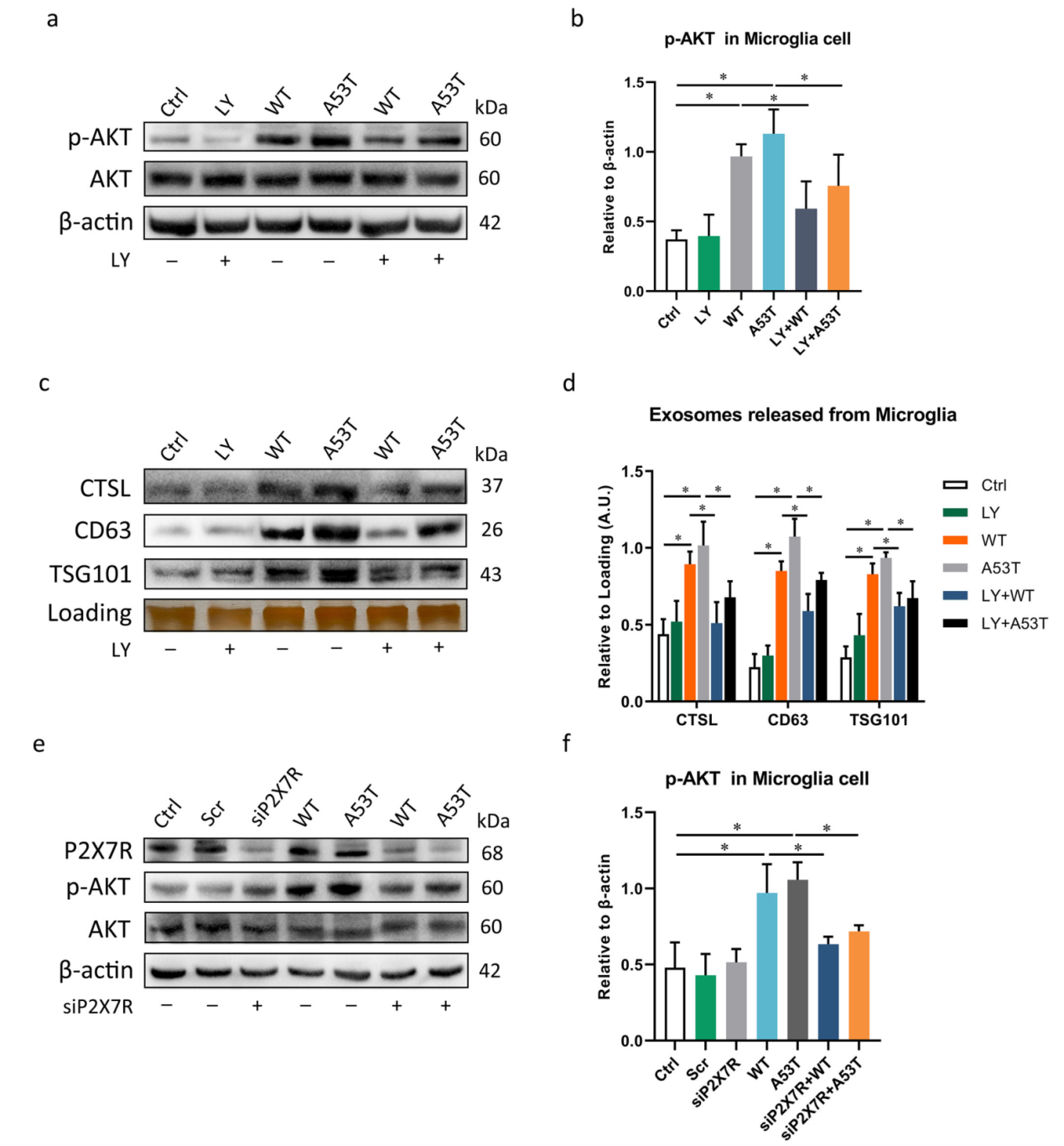
图四
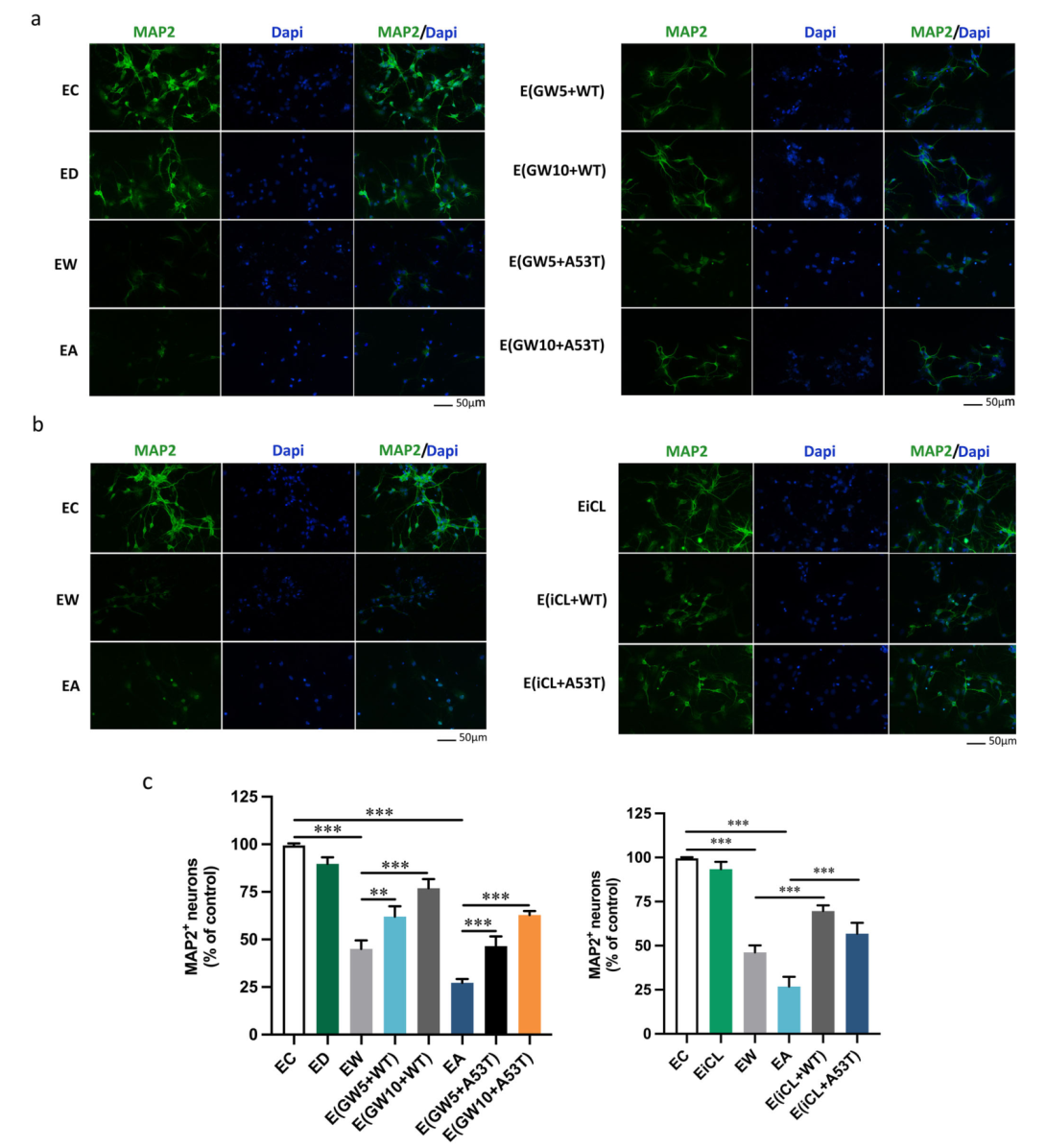
激活的小胶质细胞释放的含CTSL的外泌体促进神经元凋亡。在外泌体分离前用GW4869或CTSL抑制剂iCL处理,在每个实验组中都以剂量依赖性的方式挽救了含有CTSL的外泌体诱导的神经毒性(图五-图七)。
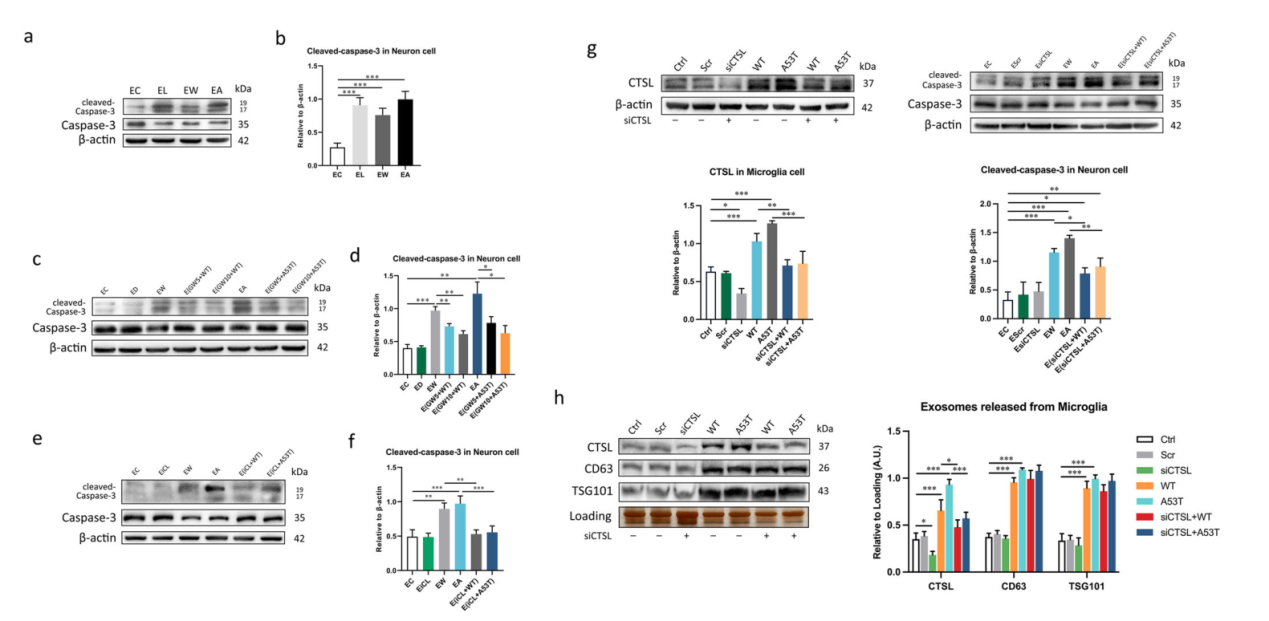
图五
图六
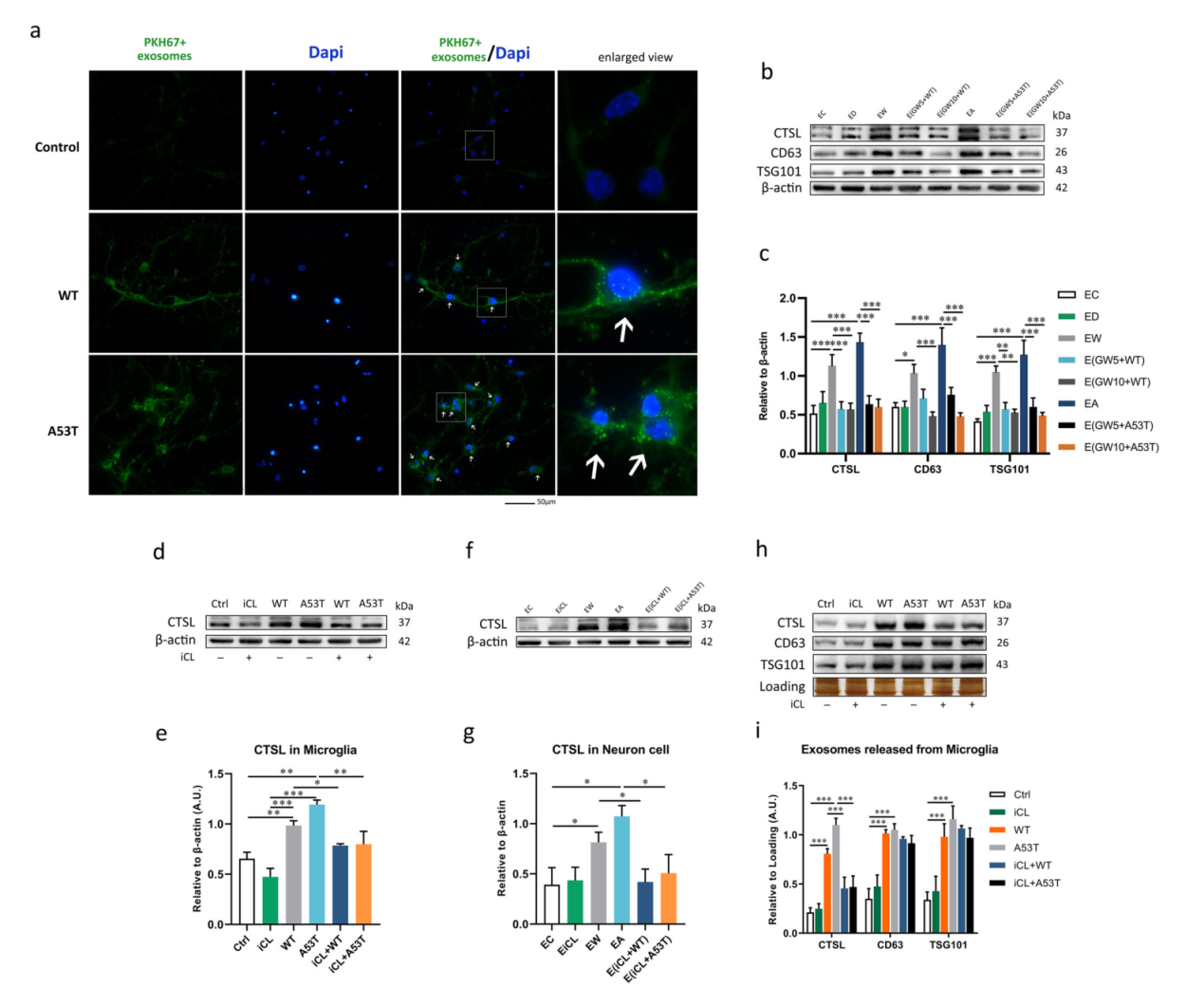
图七
外泌体资讯网 npj Parkinson’s Disease |徐俊团队:由A53T a-Syn寡聚体激活的小胶质细胞通过外泌体诱导神经毒性