9月份国内新出的细胞外囊泡/外泌体领域论文不完全统计有366篇。IF>10的57篇、IF>15的23篇、IF>20的8篇。本期主要内容包括:工程细胞外囊泡促进线粒体自噬治疗阿尔茨海默病、细胞外囊泡介导脂肪组织与大脑的交流并促进与胰岛素抵抗相关的认知障碍、牙源性干细胞外泌体治疗创伤性脑损伤的分子机制、肝星状细胞EV的HK1促进肝细胞癌的进展、体内自组装siRNA联合治疗溃疡性结肠炎、转录工程EV减轻肾移植中的同种异体反应、外泌体缓解化疗的心肌毒性、单个细胞外囊泡中的RNA特征、外泌体递送Cas9核糖核蛋白复合物用于肝脏疾病的组织特异性基因治疗等方面内容。内容十分丰富,不容错过。全部文献列表及部分文章原文可在外泌体之家论坛同名贴下下载。
1.【综述】中南大学湘雅二医院刘倘教授等:间充质干细胞衍生的外泌体在癌症治疗耐受中的作用——最新进展和治疗潜力
Lin, Z., et al. (2022). "Mesenchymal stem cell-derived exosomes in cancer therapy resistance: recent advances and therapeutic potential."
Mol Cancer 21(1): 179. IF=41.444
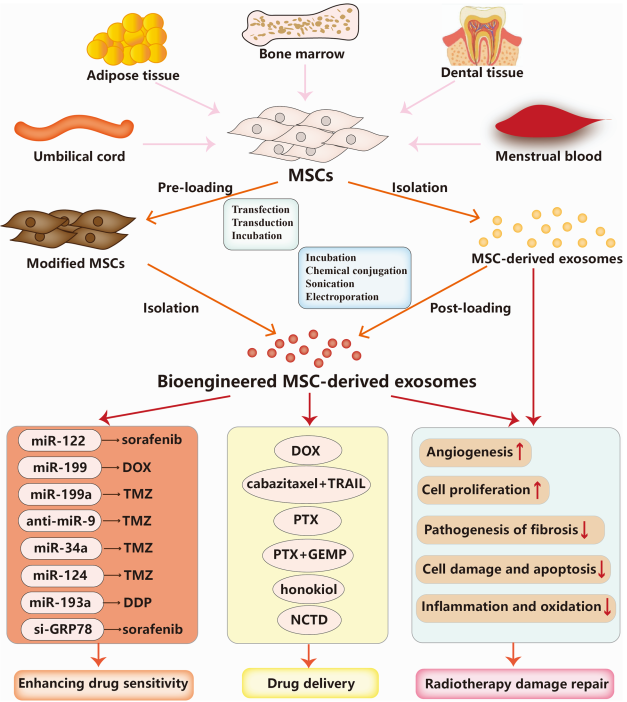
间充质干细胞(MSCs)是可以从各种人体组织和器官中获得的多能基质细胞。它们可以分化成多种细胞类型,包括成骨细胞、脂肪细胞和软骨细胞,因此在再生医学中表现出巨大的潜力。大量研究表明,间充质干细胞在癌症生物学中发挥着关键作用。已发现肿瘤细胞和MSC之间的串扰可以调节许多肿瘤行为,例如增殖、转移和上皮间质转化(EMT)。多条证据表明,间充质干细胞可以分泌可以调节肿瘤微环境并在肿瘤发展中发挥重要作用的外泌体。值得注意的是,最近的研究表明,间充质干细胞衍生的外泌体(MSC衍生的外泌体)与癌症对化疗药物、靶向治疗药物、放疗和免疫治疗的耐药性密切相关。这篇综述系统地总结了MSC衍生的外泌体在介导癌症治疗耐药中的新兴作用和详细的分子机制,从而为MSC衍生的外泌体在癌症治疗中的临床应用提供了新的见解。
2.【综述】中国医科大学魏敏杰教授等:肿瘤和肿瘤相关巨噬细胞之间的缺氧驱动串扰——机制和临床治疗策略
Bai, R., et al. (2022). "The hypoxia-driven crosstalk between tumor and tumor-associated macrophages: mechanisms and clinical treatment strategies."
Mol Cancer 21(1): 177. IF=41.444
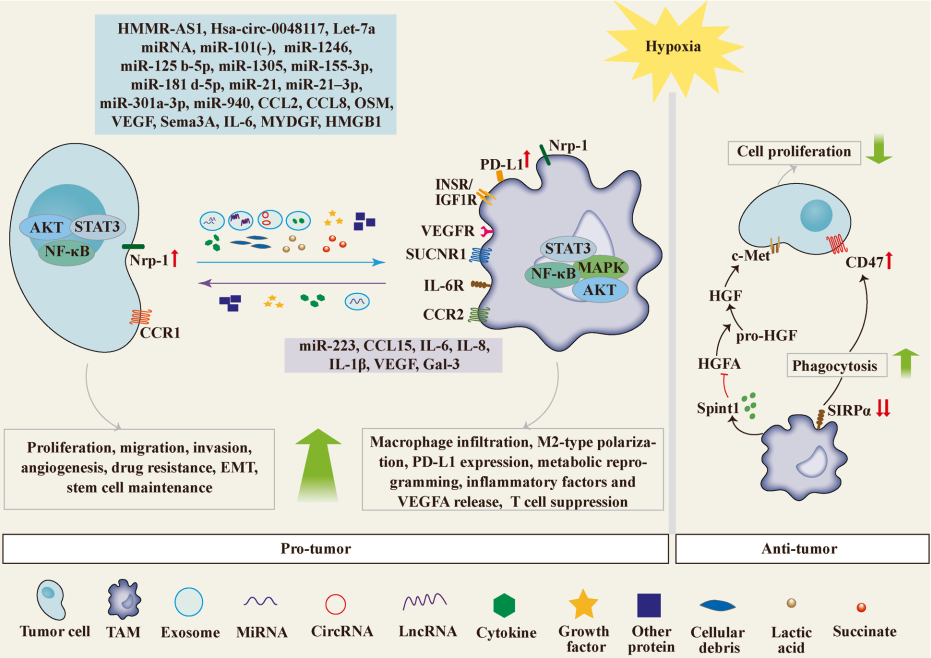
鉴于缺氧是许多不同实体瘤的持续生理特征和癌症恶性肿瘤的关键驱动因素,因此它被认为是癌症治疗的主要目标。肿瘤相关巨噬细胞(TAMs)是肿瘤微环境(TME)中最丰富的免疫细胞,对肿瘤的发展和免疫治疗有很大的影响。TAM在缺氧肿瘤区域内大量积聚。TAMs和缺氧代表了一种致命的组合,因为已经提出缺氧会诱导促肿瘤巨噬细胞表型。缺氧不仅直接影响巨噬细胞极化,而且还通过改变肿瘤细胞和巨噬细胞之间的通讯产生间接影响。例如,缺氧会影响趋化因子和外泌体的表达,这两者都会对受体细胞产生深远的影响。最近,已经证明缺氧TME中癌细胞和TAM之间复杂的相互作用与预后不良和肿瘤恶性程度增加有关。然而,关于缺氧介导的肿瘤细胞和TAM之间通讯的分子机制,没有全面的文献综述。因此,本综述旨在收集有关该主题的所有最新可用数据,并为开发减少缺氧影响的新治疗策略提供见解。
3.苏州大学汪超课题组:SHP2高表达的工程细胞外囊泡促进线粒体自噬治疗阿尔茨海默病
Xu, F., et al. (2022). "Engineered Extracellular Vesicles with SHP2 High Expression Promote Mitophagy for Alzheimer's Disease Treatment."
Adv Mater: e2207107. IF=32.086
线粒体功能障碍是阿尔茨海默病(AD)的基本病理特征。然而,现有线粒体自噬诱导剂的毒性和较差的脑富集限制了它们的进一步应用。该研究使用具有酪氨酸磷酸酶-2(SHP2)高表达(MSC-EVs-SHP2)的纳米间充质干细胞衍生的细胞外囊泡开发了AD治疗平台。MSC-EVs-SHP2的高血脑屏障穿透能力在AD小鼠中得到证实,促进了SHP2向大脑的传递。此外,MSC-EVs-SHP2显著诱导神经元细胞的线粒体自噬,从而减轻线粒体损伤介导的细胞凋亡和NLRP3炎性体激活。线粒体自噬进一步减少神经元细胞凋亡和神经炎症,最终在AD小鼠模型中挽救突触损失和认知能力下降。该EV工程技术通过诱导线粒体自噬为有效的AD治疗提供了潜在平台。
4.南京大学毕艳课题组:细胞外囊泡介导脂肪组织与大脑的交流并促进与胰岛素抵抗相关的认知障碍
Wang, J., et al. (2022). "Extracellular vesicles mediate the communication of adipose tissue with brain and promote cognitive impairment associated with insulin resistance."
Cell Metab 34(9): 1264-1279.e1268. IF=31.373
以肥胖相关胰岛素抵抗为主要表现的2型糖尿病与认知障碍风险增加有关。脂肪组织在这个过程中起着重要作用。该研究证明了脂肪组织衍生的细胞外囊泡(EVs)及其货物microRNAs(miRNAs)介导脂肪组织和大脑之间的器官间通讯,其可以以膜蛋白依赖性方式转移到大脑中并富含神经元,尤其是海马体。进一步的研究表明,来自高脂饮食(HFD)喂养的小鼠或糖尿病患者的脂肪组织衍生的EV会导致显著的突触丧失和认知障碍。这些EV中miRNA货物的消耗显著减轻了它们对认知功能的不利影响。总的来说,这些数据表明,靶向脂肪组织衍生的EV或其货物miRNA可能为糖尿病认知障碍的药物干预提供有希望的策略。
5.西安交通大学李昂、裴丹丹团队:揭示牙源性干细胞外泌体治疗创伤性脑损伤的分子机制
Li, Y., et al. (2022). "Dental stem cell-derived extracellular vesicles transfer miR-330-5p to treat traumatic brain injury by regulating microglia polarization."
Int J Oral Sci 14(1): 44. IF=24.897
前期报道:https://www.exosomemed.com/12183.html
6.武汉大学陈刚教授等:干扰素-γ通过调节程序性死亡配体1分泌诱导唾液腺样囊性癌的免疫抑制
Fu, Q., et al. (2022). "Interferon-γ induces immunosuppression in salivary adenoid cystic carcinoma by regulating programmed death ligand 1 secretion."
Int J Oral Sci 14(1): 47. IF=24.897
7.上海交通大学沈柏用教授等:缺氧诱导的外泌体circPDK1调节miR-628-3p/BPTF轴和降解BIN1,通过c-myc激活促进胰腺癌糖酵解
Lin, J., et al. (2022). "Hypoxia-induced exosomal circPDK1 promotes pancreatic cancer glycolysis via c-myc activation by modulating miR-628-3p/BPTF axis and degrading BIN1."
J Hematol Oncol 15(1): 128.IF=23.168
8.江苏大学茅凌翔教授等:Enterovirus-71利用小细胞外囊泡穿过血脑屏障,通过胞吞作用感染中枢神经系统
Gu, J., et al. (2022). "Enterovirus-71 utilizes small extracellular vesicles to cross the blood-brain barrier for infecting the central nervous system via transcytosis."
J Med Virol. IF= 20.693
9.厦门大学吴乔教授等:肝星状细胞细胞外囊泡的HK1促进肝细胞癌的进展
Chen, Q. T., et al. (2022). "HK1 from hepatic stellate cell-derived extracellular vesicles promotes progression of hepatocellular carcinoma."
Nat Metab.IF= 19.865
细胞外囊泡在肿瘤微环境中的细胞间通讯中起着至关重要的作用。该研究证明在肝纤维化中,TGF-β刺激肝星状细胞(HSC)中己糖激酶 1(HK1)的棕榈酰化,从而以TSG101依赖性方式通过大细胞外囊泡促进HK1的分泌。大的细胞外囊泡HK1被肝细胞癌(HCC)细胞劫持,导致糖酵解加速和HCC进展。在HSCs中,核受体Nur77转录激活去棕榈酰酶ABHD17B的表达以抑制HK1棕榈酰化,从而减弱HK1的释放。然而,TGF-β激活的Akt通过诱导Nur77磷酸化和降解在功能上抑制Nur77。该研究确定了结合Nur77产生空间位阻以阻断Akt靶向的小分子PDNPA,从而破坏Akt介导的Nur77降解并保持Nur77对HK1释放的抑制。总之,这项研究证明了HK1在从HSC释放后在HCC中被忽视的功能,并强调PDNPA作为抑制HCC进展的候选化合物。
10.【综述】中国医学科学院血液病医院程涛教授,程辉研究员联合上海交通大学医学院郑俊克教授:细胞外囊泡在正常造血及血液肿瘤中的作用
Sun, G., et al. (2022). "Emerging roles of extracellular vesicles in normal and malignant hematopoiesis."
J Clin Invest 132(18). IF= 19.456
前期报道:https://www.exosomemed.com/12220.html
11.西南交通大学杨苹教授等:带有Lp-PLA(2)触发释放的外泌体负载Pro-efferocytic血管支架,用于预防支架内再狭窄
Zou, D., et al. (2022). "Exosome-Loaded Pro-efferocytic Vascular Stent with Lp-PLA(2)-Triggered Release for Preventing In-Stent Restenosis."
ACS Nano 16(9): 14925-14941. IF=18.027
12.广东省人民医院:用于光声成像引导的光触发精确化学免疫疗法的肿瘤归巢和免疫重编程细胞纳米囊泡
Fan, Z., et al. (2022). "Tumor-Homing and Immune-Reprogramming Cellular Nanovesicles for Photoacoustic Imaging-Guided Phototriggered Precise Chemoimmunotherapy."
ACS Nano. IF=18.027
许多研究都集中在开发有效的治疗策略以选择性地破坏原发性肿瘤、消除转移性病变和预防肿瘤复发,同时对正常组织的副作用最小。该研究合成了具有肿瘤归巢和免疫重编程功能的工程细胞纳米囊泡(ECNV),用于光声(PA)成像引导的精准化学免疫疗法。M1-巨噬细胞衍生的细胞纳米囊泡(CNV)装载有金纳米棒(GNR)、吉西他滨(GEM)、CpGODN和PD-L1适体。CNVs良好的组织相容性和肿瘤归巢效应改善了药物在血流中的保留,并导致它们在肿瘤组织中富集。此外,GNR的光热能力使PA成像引导药物释放成为可能。GEM诱导肿瘤免疫原性细胞死亡(ICD),CpGODN促进对ICD释放的抗原的免疫反应,导致长期特异性抗肿瘤免疫。此外,PD-L1适体减轻了PD1/PD-L1检查点对CD8(+)T细胞的抑制作用,增强了免疫治疗作用。协同的先天性和适应性免疫反应增强了ECNVs的抗肿瘤作用。总之,该纳米平台将局部靶向光热疗法与广泛的渐进化疗相结合,并使用ICD重塑肿瘤消融的免疫微环境。
13.南京大学陈熹教授、张辰宇教授:体内自组装siRNA作为溃疡性结肠炎联合治疗的一种方式
Zhou, X., et al. (2022). "In vivo self-assembled siRNA as a modality for combination therapy of ulcerative colitis."
Nat Commun 13(1): 5700.IF= 17.694
鉴于溃疡性结肠炎的复杂性,可能需要针对溃疡性结肠炎的多种致病基因和途径的联合治疗。不幸的是,目前的治疗策略通常基于独立的化合物或单克隆抗体,而联合治疗在溃疡性结肠炎治疗中的全部潜力尚未实现。该研究开发了一种合成生物学策略,将天然存在的小细胞外囊泡循环系统与人工遗传回路相结合,以重新编程雄性小鼠的肝脏,将多个siRNA自组装成分泌性小细胞外囊泡,并通过循环小泡促进体内递送siRNA。细胞外囊泡用于溃疡性结肠炎小鼠模型的联合治疗。特别是反复注射设计用于同时抑制TNF-α、B7-1和整合素α4的多靶点遗传回路,可通过抑制结肠巨噬细胞中的促炎级联反应,迅速缓解肠道炎症并发挥协同治疗溃疡性结肠炎的作用,抑制T细胞的共刺激信号并阻止T细胞归巢到炎症部位。更重要的是,该研究设计了一个AAV驱动的遗传回路,仅通过一次注射即可诱导对TNF-α、B7-1和整合素α4的实质性和持久抑制。总体而言,这项研究为溃疡性结肠炎建立了一种可行的联合治疗策略,这可能为需要两种或多种独立化合物或抗体的传统生物疗法提供替代方案。
14.重庆医科大学陈压西教授与伦敦大学学院合作:CD36介导的肿瘤细胞和巨噬细胞之间的代谢串扰影响肝转移
Yang, P., et al. (2022). "CD36-mediated metabolic crosstalk between tumor cells and macrophages affects liver metastasis."
Nat Commun 13(1): 5782. IF= 17.694
肝转移具有高度侵袭性和难治性,部分原因是巨噬细胞介导的免疫抑制。了解导致肿瘤微环境(TME)中巨噬细胞功能重编程的机制将有利于癌症免疫治疗。该研究发现清道夫受体CD36在转移相关巨噬细胞(MAM)中上调,并且MAM中CD36的缺失减弱了小鼠的肝转移。MAM含有更多的脂滴,并具有吞噬由细胞外囊泡携带的肿瘤细胞衍生的长链脂肪酸的独特能力。富含脂质的囊泡通过CD36优先分配到巨噬细胞中,这为巨噬细胞提供燃料并触发其促肿瘤活动。在肝转移患者中,CD36的高表达与肿瘤前M2型MAM浸润相关,从而产生高度免疫抑制的TME。总的来说,该研究结果揭示了肿瘤细胞在TME中与巨噬细胞代谢相互作用的机制,并表明靶向CD36作为肝转移免疫疗法的治疗潜力。
15.中山大学中山医学院李隽教授、宋立兵教授等:载有大Oncosome的VAPA通过形成破骨细胞转移前小生境促进肝细胞癌的向骨转移
Zhang, S., et al. (2022). "Large Oncosome-Loaded VAPA Promotes Bone-Tropic Metastasis of Hepatocellular Carcinoma Via Formation of Osteoclastic Pre-Metastatic Niche."
Adv Sci (Weinh): e2201974. IF=17.521
肿瘤来源的细胞外囊泡(EVs)在选择性调节远处器官的微环境中发挥关键介质的作用,以产生促进器官转移的转移前生态位。识别EV的器官特异性分子决定因素可以开发潜在的抗转移治疗靶点。在目前的研究中,发现大型肿瘤体(Large Oncosome, LO),非典型的大型癌症衍生EV,通过设计破骨细胞前转移生态位和建立恶性转移,在促进肝细胞癌(HCC)细胞向骨转移中发挥关键作用。破骨细胞和HCC细胞之间的循环。跨膜蛋白,VAMP相关蛋白A(VAPA),通过与LOs标志物αV-整合素的直接相互作用,在LOs表面显著富集。富含VAPA的LO诱导的转移前教育将骨骼转变为肥沃的环境,从而支持转移性HCC细胞的生长。在机制上,LOs传递的VAPA整合到破骨细胞的质膜,并通过双重机制直接与神经Wiskott-Aldrich综合征蛋白(N-WASP)相互作用并激活,从而导致ARP2/3复合物介导的破骨细胞中肌动蛋白细胞骨架的重组和破骨细胞生成。重要的是,用N-WASP抑制剂187-1包装的LOs(LOs/187-1)治疗可显著消除富含VAPA的LOs对转移前生态位形成的诱导作用,并防止HCC骨转移。这些发现揭示了HCC骨趋向性的合理机制,并且可以代表预防HCC骨转移的潜在策略。
16.浙江大学陈江华教授:转录工程细胞外囊泡减轻肾移植中的同种异体反应动力学
Lin, J., et al. (2022). "Transcript Engineered Extracellular Vesicles Alleviate Alloreactive Dynamics in Renal Transplantation."
Adv Sci (Weinh): e2202633. IF=17.521
膜分子的直接接触和细胞因子相互作用协调免疫稳态。然而,克服距离和速度障碍的阈值,实现粘附介导的免疫相互作用仍然很困难。在这里,受调节性T细胞的自然趋化性的启发,设计了多功能化FOXP3基因工程细胞外囊泡,称为Foe-TEV,其显示与涉及CTLA-4和PD-1的粘附分子、调节细胞因子和共抑制接触分子,通过有限的外源基因转导。Foe-TEVs有效地粘附在同种异体肾移植物中同种异体损伤的肾小管、内皮和肾小球区域,从而减轻细胞原位死亡和慢性纤维化转变。值得注意的是,转录工程将囊泡的跟踪速度逆转为保留的表型,并将阻滞系数提高2.16倍,直接相互作用并减弱适应性淋巴器官中过度的同种异敏化动力学。在小鼠同种异体移植中,免疫粘合剂Foe-TEVs可减轻病理反应,恢复肾功能,具有良好的超微结构和提高的肾小球滤过率,并将受体的存活期从30.16天延长至92.81天,证明了细胞外囊泡的传递,遗传专为免疫粘合剂而设计,是治疗移植排斥的有前途的策略。
17.南方医科大学附属东莞医院李振华团队:外泌体诱饵解决肿瘤化疗引起的心肌毒性
Fan, M., et al. (2022). "Decoy Exosomes Offer Protection Against Chemotherapy-Induced Toxicity."
Adv Sci (Weinh): e2203505. IF=17.521
前期报道:https://www.exosomemed.com/12136.html
18.清华大学药学院刘刚教授等:结直肠癌肝转移的新机制
Wei, X., et al. (2022). "Extracellular vesicles from colorectal cancer cells promote metastasis via the NOD1 signalling pathway."
J Extracell Vesicles 11(9): e12264. IF=17.337
前期报道:https://www.exosomemed.com/12147.html
19.中国医学科学院北京协和医院张太平教授:HCC EV ECG评分——一种基于细胞外囊泡的蛋白质测定法,用于检测早期 HCC
Luo, W., et al. (2022). "Letter to the editor: HCC EV ECG score: An extracellular vesicle-based protein assay for detection of early-stage HCC."
Hepatology. IF= 17.298
20.上交大附属第六人民医院汪泱/李青:iPS-MSCs来源大细胞外囊泡通过调节巨噬细胞异质性缓解肌腱病
Ye, T., et al. (2023). "Large extracellular vesicles secreted by human iPSC-derived MSCs ameliorate tendinopathy via regulating macrophage heterogeneity."
Bioact Mater 21: 194-208. IF= 16.874
前期报道:https://www.exosomemed.com/12230.html
21.【综述】中国人民解放军总医院:细胞外囊泡通过微环境调控在骨关节炎治疗中的作用
Yin, H., et al. (2022). "The role of extracellular vesicles in osteoarthritis treatment via microenvironment regulation."
Biomater Res 26(1): 52.IF=15.863
22.华中科技大学郭安源教授:单个细胞外囊泡中的RNA特征
Luo, T., et al. (2022). "Transcriptomic Features in a Single Extracellular Vesicle via Single-Cell RNA Sequencing."
Small Methods: e2200881.IF= 15.367
前期报道:https://www.exosomemed.com/12142.html
23.复旦大学蒋晨教授:抗外泌体铁外流的三重治疗策略,用于增强铁死亡治疗和免疫治疗
Wang, Y., et al. (2022). "A Triple Therapeutic Strategy with Antiexosomal Iron Efflux for Enhanced Ferroptosis Therapy and Immunotherapy."
Small: e2201704. IF=15.153
铁死亡是一种受调控的细胞死亡形式,它不仅可以杀死肿瘤细胞,还可以增强肿瘤细胞的免疫原性,已被证明与多种肿瘤治疗有关,尤其是在癌症免疫治疗中。据报道,肿瘤细胞衍生的外泌体影响肿瘤的进展和转移过程。在铁死亡过程中,外泌体也被证明是在细胞内高铁浓度下输出铁并抵抗铁死亡的介质。在这方面,铁死亡诱导剂和含铁外泌体抑制剂的联合应用可能会增强铁死亡。在此,构建了由氧化铁纳米颗粒、附有奥沙利铂的聚合物和siProminin2组成的生物相容性混合纳米颗粒。siProminin2介导的外泌体抑制可以恢复细胞内铁浓度,这也可以抑制肿瘤细胞衍生的外泌体的分泌。免疫疗法与奥沙利铂、基于铁死亡的癌症疗法和抑制肿瘤细胞衍生的外泌体相结合可以增强免疫激活作用。纳米颗粒代表了一种出色的三联疗法,可用于增强基于铁死亡的癌症疗法和免疫疗法。
24.浙江大学刘祥瑞教授等:外泌体介导的Cas9核糖核蛋白复合物递送用于肝脏疾病的组织特异性基因治疗
Wan, T., et al. (2022). "Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases."
Sci Adv 8(37): eabp9435. IF=14.957
CRISPR-Cas9基因编辑已成为一种强大的治疗技术,但缺乏安全有效的体内递送系统,尤其是组织特异性载体,限制了其广泛的临床应用。Cas9核糖核蛋白(RNP)的递送比其他选择具有竞争优势;然而,RNP的大尺寸超出了当前可用传递载体的负载能力。该研究报告了一种以前未知的基因组编辑传递系统,称为外泌体(RNP),其中Cas9RNP通过电穿孔被加载到从肝星状细胞中分离出来的纯化外泌体中。外泌体(RNP)促进了RNP在体外的有效胞质递送,同时在体内特异性地积累在肝组织中。外泌体(RNP)通过靶向p53上调凋亡调节剂(PUMA)、细胞周期蛋白E1(CcnE1)和K(赖氨酸)乙酰转移酶5(KAT5)在急性肝损伤、慢性肝纤维化和肝细胞癌小鼠模型中显示出强大的治疗潜力。开发的外泌体(RNP)为肝脏疾病的精确和组织特异性基因治疗提供了一个可行的平台。
全部文献列表及部分文章原文可在外泌体之家论坛同名贴下下载。(百度:外泌体之家;或网址:www.exosome.com.cn)
以上,9月份国内细胞外囊泡/外泌体领域研究进展的月总结整理。感谢大家关注!愿有所收获。下个月见!
外泌体资讯网 国内外泌体领域进展总结(2022年9月)