外泌体是肿瘤微环境中的重要组分,口腔鳞癌细胞可以通过外泌体的途径将遗传物质传递至肿瘤微环境中的其它细胞,如血管内皮细胞、肿瘤细胞、巨噬细胞等,从而调控肿瘤的快速增殖、远处转移、血管生成等过程。苯乙双胍(Phenformin)是二甲双胍的衍生物,曾应用于治疗II型糖尿病,因其在治疗过程中导致乳酸酸中毒的发生率较高而被禁止使用。但近些年的研究发现苯乙双胍具有广泛的抗癌作用,且与二甲双胍相比,同等剂量下苯乙双胍具有更优越的抗癌效果。最近的研究显示苯乙双胍的抗癌作用不仅通过直接作用肿瘤细胞,同时也作用肿瘤微环境的调控来实现。因此进一步探究苯乙双胍是否可以通过改变肿瘤微环境发挥抑癌作用是研究苯乙双胍抗癌机制必不可少的一环。
2022年9月8日,山东大学口腔医学院/杭州医学院宁波口腔医院吴训伟团队在Frontiers in Oncology上发表了题为“Phenformin suppresses angiogenesis through the regulation of exosomal microRNA-1246 and microRNA-205 levels derived from oral squamous cell carcinoma cells”的文章,阐述了苯乙双胍通过调节口腔鳞癌细胞外泌体中miR-1246及miR-205的水平抑制血管生成的作用及其作用机制。该文章的第一作者为山东大学口腔医学院庄德轩硕士生。该团队针对苯乙双胍是否可以通过调控口腔鳞癌细胞分泌的外泌体,改变肿瘤微环境来发挥抑癌作用开展了一系列的研究。
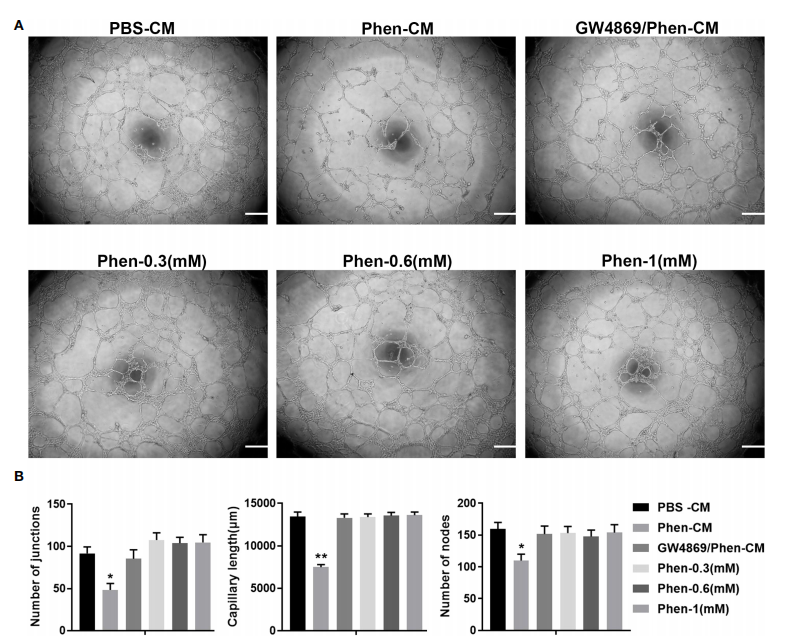
研究者首先通过体外管腔形成实验发现,苯乙双胍处理口腔鳞癌细胞收集的条件培养基(Phen-CM)具有体外抑制管腔形成的作用,而在加入外泌体抑制剂(GW4869)后可以明显挽救该抑制作用,且3种不同浓度的苯乙双胍直接刺激对血管内皮细胞管腔形成无明显影响。该结果提示苯乙双胍通过肿瘤微环境抑制血管生成与外泌体密切相关(图一)。
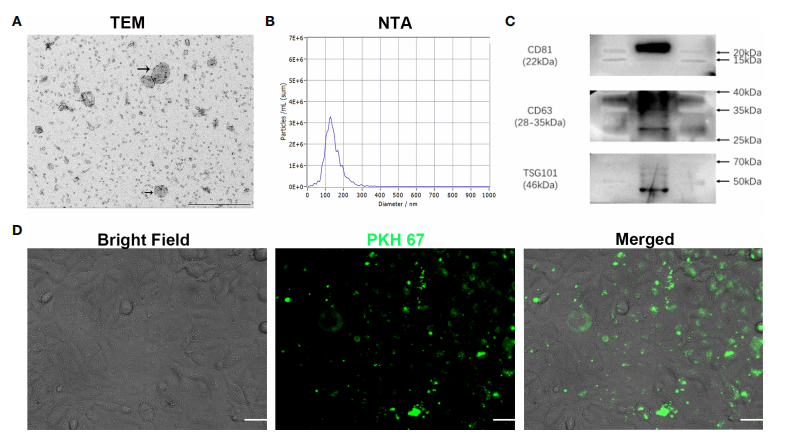
图一随后通过透射电镜、纳米粒子跟踪分析技术和Western blot实验验证提取的微囊泡为外泌体,且PKH 67标记的外泌体可被血管内皮细胞吞噬至细胞内(图二)。
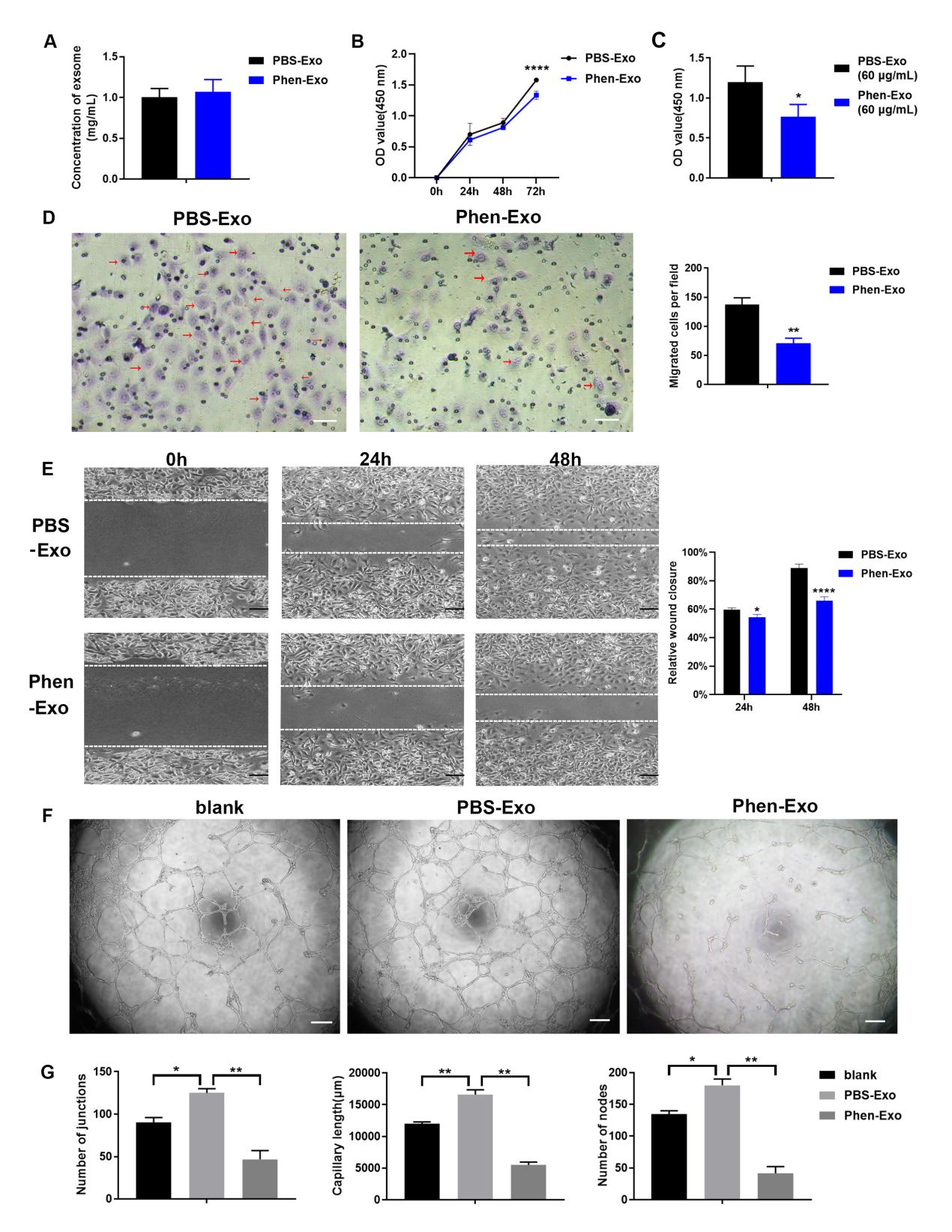
图二经外泌体浓度检测,苯乙双胍刺激并不会改变口腔鳞癌细胞分泌的外泌体总量,通过CCK-8试验、Transwell小室试验和细胞划痕实验、体外管腔形成实验分别证明了苯乙双胍刺激口腔鳞癌细胞分泌的外泌体(Phen-Exo)可以显著抑制血管内皮细胞的增殖、迁移及管腔形成(图三)。
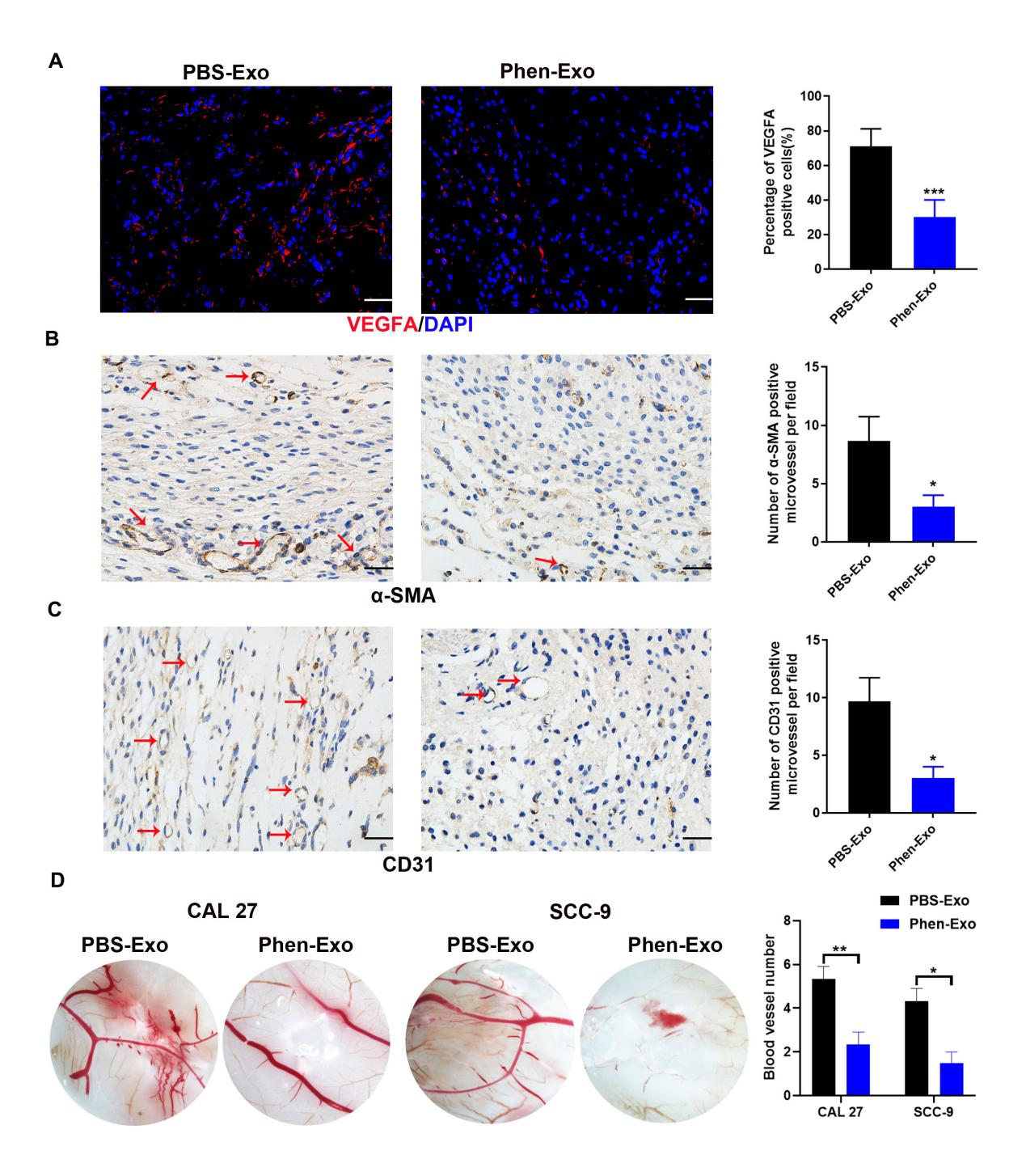
图三将外泌体和血管内皮细胞的混合液移植到裸鼠皮下进行裸鼠体内成血管实验,收集移植物通过免疫荧光染色和免疫组化染色检测成血管指标表达量,Phen-Exo组成血管指标显著降低。并通过鸡胚绒毛尿囊膜血管生成实验进一步证明Phen-Exo在体内显著抑制血管的形成(图四)。
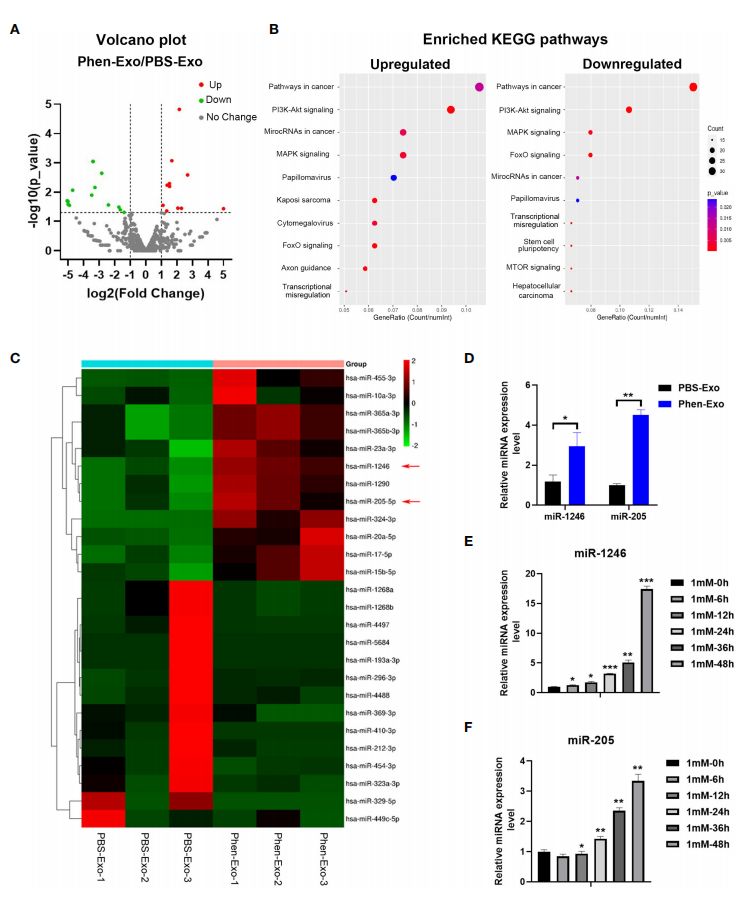
图四借助外泌体miRNA测序技术,筛选出PBS-Exo与Phen-Exo的差异miRNAs并通过qRT-PCR实验验证,结果表明Phen-Exo中富集了更多的miR-1246和miR-205;且苯乙双胍直接刺激口腔鳞癌细胞也会使细胞中的miR-1246、miR-205的表达量出现明显升高。该结果提示苯乙双胍可以促进口腔鳞癌细胞高表miR-1246和miR-205,从而导致外泌体中miR-1246、miR-205水平升高(图五)。
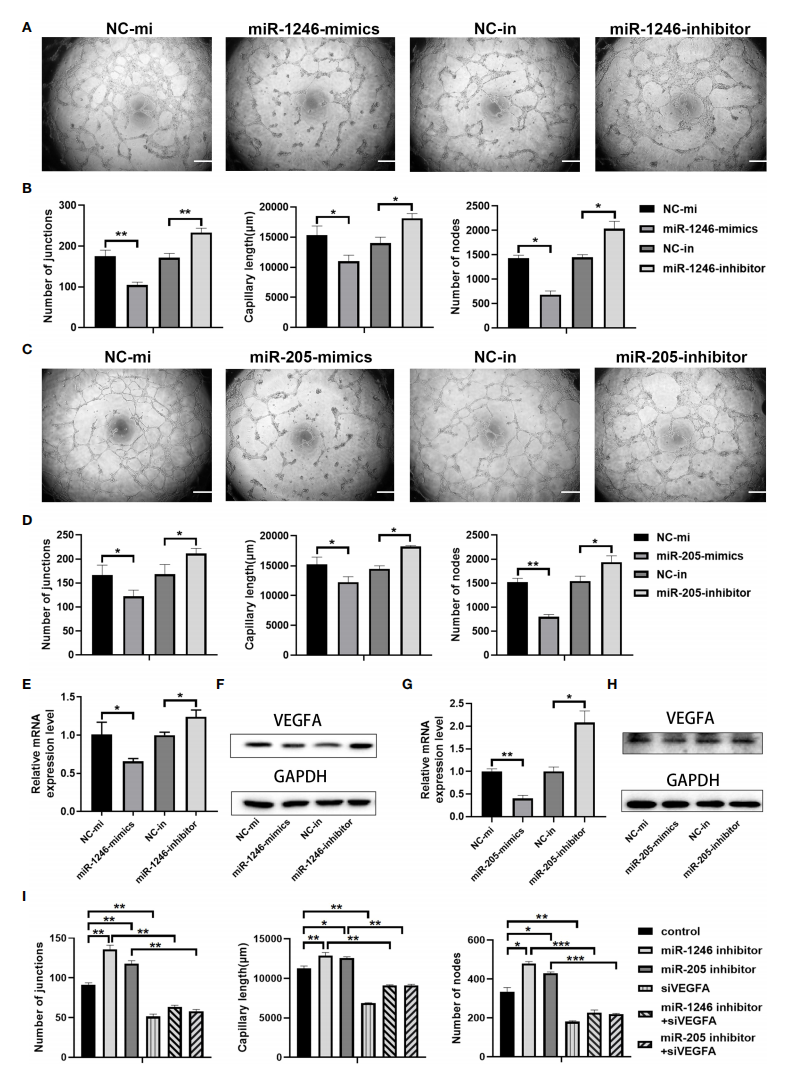
图五进一步通过体外管腔形成实验、qRT-PCR实验及Western blot实验进行相关分子通路的验证。明确Phen-Exo抑制管腔生成的作用是通过高表达miR-1246和miR-205实现的,且该功能与miR-1246和miR-205抑制血管内皮细胞中VEGFA的表达有关(图六)。
图六参考文献:Phenformin suppresses angiogenesis through the regulation of exosomal microRNA-1246 and microRNA-205 levels derived from oral squamous cell carcinoma cells. Frontiers in Oncology. DOI 10.3389/fonc.2022.943477
外泌体资讯网 FRONT ONCOL|山东大学/杭州医学院宁波口腔医院吴训伟:苯乙双胍通过调节口腔鳞癌细胞外泌体中miRNAs水平抑制血管生成