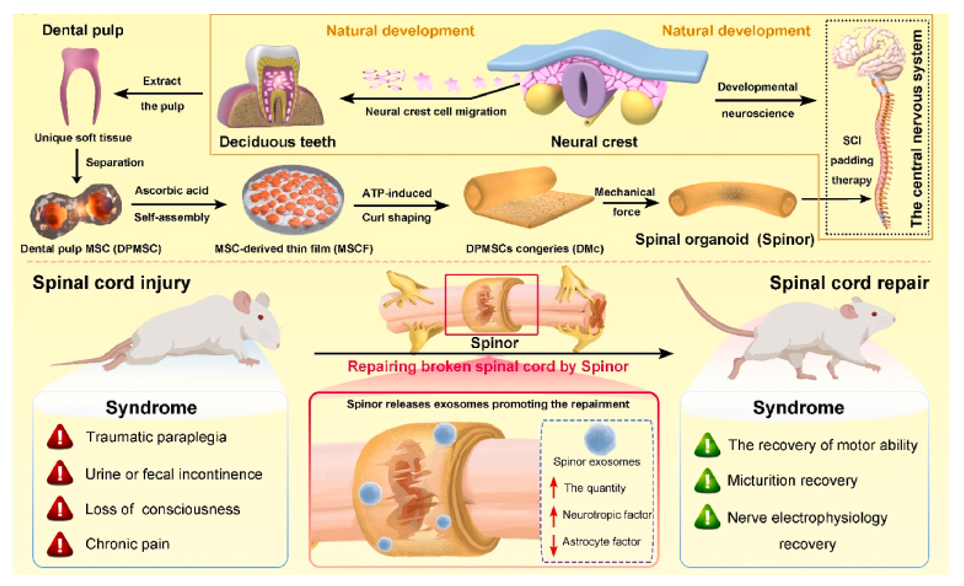
Materials Today Bio |西安交通大学第一、二附属医院团队:发育工程化的生物装配体释放神经营养外泌体引导脊髓损伤后的原位神经重塑脊髓损伤(SCI)是最难治疗的中枢神经系统损伤之一,常导致患者的身体功能障碍甚至瘫痪。脊髓损伤后,为了应对神经元活动和结缔组织神经反馈的需求,理论上横断的轴突以各种形式自发地在损伤部位再生和重塑,断裂的神经回路可以重新组织,从而恢复生理功能。大量研究证实,SCI后形成的星形胶质细胞疤痕屏障和炎性微环境,致使轴突难以真正成功再生,尤其是长距离再生。临床上常规外科手术联合注射神经促进因子治疗SCI,尽管可有效降低死亡率,但不能有效逆转病程和临床结果。近年来基于干细胞的“组织工程先进治疗药物”(TE-ATMPs),尤其是组织工程生物装配体,在慢性SCI临床治疗上取得了一些积极的进展。然而在如何增强损伤轴突的再生,以及恢复损伤脊髓的功能方面仍存在重大挑战。越来越多的研究证实间充质干细胞(MSC)及其来源的外泌体具有促进轴突生长、抑制星形胶质细胞疤痕并减轻炎症的强大生物学功能,提示MSC及其来源的外泌体在SCI治疗中的潜在作用。由于外泌体临床应用的自身局限性,目前为止,尚未有任何外泌体或其衍生物被批准用于促进神经可塑性的临床应用。近日,西安交通大学第二附属医院刘文佳教授和西安交通大学第一附属医院何旺骁研究员、西安交通大学第二附属医院闫瑾研究员在Materials Today Bio杂志上发表题为“Developmentally engineered bio-assemblies releasing neurotrophic exosomes guide in situ neuroplasticity following spinal cord injury”的研究论文(doi: 10.1016/j.mtbio.2022.100406),详细阐述了利用“发育工程学”原理构建的生物装配体有效治疗完全横断脊髓损伤模型及其潜在的治疗机理。研究员闫瑾和博士生张立强为共同第一作者,刘文佳教授、何旺骁研究员为共同通讯作者。
该研究首先比较了牙髓间充质干细胞(DPMSC)、脐带间充质干细胞(UCMSC)和骨髓间充质干细胞(BMMSC)来源的外泌体促进神经元分化的作用。结果显示DPMSC来源的外泌体更有利于神经元分化。随后,作者利用“发育工程学”原理,通过促进细胞外基质分泌、调控能量代谢以及机械力刺激,将DPMSCs组装为生物装配体。该装配体具有与天然脊髓类似的理化特性及结构强度,故将其命名为“Spinor”。
随后,该研究对比了DPMSC和Spinor来源的外泌体数量、表征及其生物学功能。结果显示相较对照DPMSC,Spinor可以分泌更多的外泌体,且生物信息学分析显示来源于Spinor的外泌体富含更多的细胞自组装蛋白和神经营养蛋白,而与胶质细胞增殖和炎症相关的蛋白则显著减少,提示Spinor外泌体更有利于脊髓再生。生物学功能结果显示Spinor来源的外泌体活性更好,能有效促进脊髓功能恢复及神经元再生。进一步,该研究利用CD63-GFP示踪在体条件下Spinor和DPMSC在治疗SCI过程中外泌体的分泌情况。移植1周结果显示,Spinor的外泌体数量和分布区域明显优于DPMSC组。最后,动物实验结果显示,相对于DPMSC组,Spinor移植显著加速感觉神经功能和排尿功能的恢复,并较大程度地改善运动功能。组织学结果,与DPMSC组比较,Spinor组明显促进损伤区域内神经纤维及神经元再生并且抑制星形胶质细胞增殖,且减轻炎症并减少炎症诱导的细胞凋亡。综上所述,Spinor将为严重甚至完全的脊髓损伤提供一个有前景的临床治疗方案,并为增强干细胞来源外泌体的在体应用提供新思路。
参考文献:Developmentally engineered bio-assemblies releasing neurotrophic exosomes guide in situ neuroplasticity following spinal cord injury, Mater Today Bio. 2022 Aug 24;16:100406. doi: 10.1016/j.mtbio.2022.100406. eCollection 2022 Dec.
外泌体资讯网 Mater Today Bio |西安交大第一、二附属医院:发育工程化的生物装配体释放神经营养外泌体引导脊髓损伤后的原位神经重塑