新冠病毒等新病原体的出现需要迫切的治疗方案开发,但需要严格的生物安全处理程序并应对基因组的快速突变,这对治疗药物的开发提出了巨大挑战。siRNA可以靶向新冠病毒的关键蛋白表达基因,并可以通过外泌体的递送实现有效治疗。来自美国3P Biotechnologies公司的研究人员使用基于牛乳外泌体的递送系统来开发针对病毒关键基因序列的siRNA,帮助科研界能够在较低生物安全水平下的完成治疗方法的开发。相关研究以“A model system for antiviral siRNA therapeutics using exosome-based delivery”为题将于9月13日在新一期的Mol Ther Nucleic Acids杂志上发表。
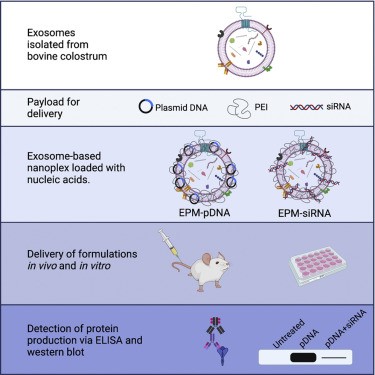
新冠病毒的这三年流行,人们尝试了各种治疗方案,在这个基因组学时代催生了许多分子治疗的可能性,比如基于基因的疫苗。但目前,仍然缺乏新冠病毒感染的可行药物,这凸显了对基于新技术的治疗方法的需求。然而,阻碍病毒技术发展的一个限制是缺少研究活病毒(如 SARS-CoV-2)的生物安全3级实验室;另外,这些高传染性病毒的快速突变,会产生更危险的变体,逃避疫苗反应和自然获得性免疫。这凸显了对新一代抗病毒疗法的需求,例如靶向基因疗法。现有的模型,例如假病毒系统,虽然可用于研究细胞动力学,但不适用于研究基于基因组的疗法,因为它们通常只涵盖单一序列的单个病毒抗原。因此,在较低的生物安全风险水平上探索针对新冠病毒等新兴病原体的基因疗法的策略是当务之急。小干扰RNA (siRNA) 被广泛用于基因治疗,在阿尔茨海默症和胰腺癌中已经进行了siRNA靶向疾病。尽管抗病毒siRNA可以预防和治疗鼠模型的病毒感染,但抗病毒siRNA并没有从实验室发展到临床。siRNA广泛临床应用的一个主要障碍是缺乏合适的递送系统到提供有效治疗目标;另外,未受保护的siRNA不易被细胞吸收,容易被RNA酶降解。因此,递送系统的出现开始解决这些问题。siRNA的递送方式通常被分为病毒或非病毒方式。病毒介导的siRNA递送使用来源于病毒(如腺病毒)的复制缺陷型病毒颗粒,但腺病毒缺乏组织嗜性、递送的瞬时效应、剂量限制和潜在肝毒性。此外,递送颗粒本身可能具有免疫原性容易被清除。非病毒转染方法也存在局限性:聚阳离子和阳离子脂质体在体外使用,几乎不能直接转化为体内方式;脂质体和脂质纳米颗粒 (LNP) 缺乏组织特异性,并且在几乎所有器官中均等分布,可能产生基因敲除的脱靶效应。选择性器官靶向 (SORT)的LNP能增加某些器官(例如肝脏和脾脏)的靶向性,但未能在新冠病毒的靶器官——肺上带来改善。而且,siRNA递送体在器官的积累并不能保证递送的siRNA最大程度的用于治疗。天然纳米颗粒(例如外泌体)递送siRNA提供了比其他递送系统的显著优势。外泌体在人体中无处不在,存在于许多体液中,天生能够促进细胞间通讯和生物分子的传递。外泌体蛋白质标志物,如CD47,可延长体内循环并防止巨噬细胞吞噬。通过将配体连接到外泌体表面蛋白上,可以进一步增强组织靶向性。但是,外泌体大规模生产的限制再次阻碍了临床转化。在本研究里,研究人员使用的是牛乳/牛初乳外泌体,比人类细胞系衍生的外泌体具有优势:牛乳外泌体无全身毒性和免疫毒性。牛乳/牛初乳外泌体还可以递送小分子和生物制剂,可用于大规模生产。因为外泌体由带负电荷的脂质双层膜组成,外泌体和核酸之间的结合必须通过电荷相互作用的调节剂来促进。聚阳离子,如聚乙烯亚胺 (PEI),长期以来一直用于转染真核细胞系,但具有分子毒性。外泌体和聚乙烯亚胺纳米复合物 (EPM) 可以使细胞毒性最小化。此外,乳铁蛋白(LF)具有抗菌和抗病毒特性,许多病毒进入通过LF受体进入宿主细胞。用LF功能化外泌体可以增强有效载荷向病毒感染细胞的传递。除了siRNA疗法的递送系统优化,基于核酸的疗法的病毒靶标和寻找最大治疗效果的序列也非常重要。新冠病毒基因组有近30,000个碱基,25种蛋白质的编码序列。研究人员确定了几个siRNA靶点:(1)刺突糖蛋白通过与ACE2受体的相互作用介导所有冠状病毒进入细胞,其中包含特定受体结合域 (RBD) 的 S1亚基免疫原性最高。(2)病毒核衣壳 (N) 介导病毒基因组包装和病毒颗粒释放中,诱导抗体产生。(3)病毒复制酶 (RdRp) 对病毒复制至关重要,是病毒治疗药物(如瑞德西韦)的靶点。在这项研究里,研究人员设计了基于牛初乳外泌体的纳米颗粒递送系统EPM(外泌体-PEI基质),克服了严格的生物安全限制,用于模拟病毒蛋白的表达。EPM 技术可以同时传递质粒DNA和siRNA,模拟病毒基因表达、筛选潜在的抗病毒 siRNA。使用这个纳米平台,三种关键的新冠病毒蛋白(刺突糖蛋白、核衣壳和复制酶)在体内外表达。在体外,筛选了几种病毒基因靶向siRNA 以确定敲低效率,其中一些siRNA 双链体可以使相应蛋白质表达敲低80%-95%。此外,通过EPM引入刺突蛋白和核衣壳的体内实验,产生针对病毒抗原的抗体。总之,这些发现证明EPM递送系统的有效性,可以在低生物安全水平上筛选抗病毒治疗方案。参考文献: A model system for antiviral siRNA therapeutics using exosome-based delivery. Mol Ther Nucleic Acids. 2022;29:691-704.




