胞外囊泡(EV)是细胞释放的脂质双分子层包裹的囊泡,内含母体细胞来源的蛋白质和核酸,主要介导细胞间通讯。尽管EV的生成机制尚不完全清楚 ,但根据其释放机制和大小,EV通常被分为三类:外泌体、微囊泡和凋亡小体。MISEV2018则进一步将小于200纳米的EV,定义为小胞外囊泡(sEV),这其中包含外泌体和部分较小的微囊泡。相较于大于200纳米的EV,sEV可以有效逃避,组织内巨噬细胞和血液里单核细胞的吞噬,使得sEV可以介导长距离的细胞间通讯。因此,近年来sEV是该领域的研究热点。过往研究发现sEV中存在线粒体DNA和单链DNA。近年来的研究又证实sEV中含有基因组双链DNA片段和染色体外环状DNA。那么问题来了,DNA是如何被包装进sEV的?外泌体和微囊泡分别是通过溶酶体途径和细胞膜出芽方式形成的。在此过程中,只有细胞质中的RNA和蛋白质可以被分类并封装到外泌体和微囊泡中。它们的形成过程并不涉及细胞核、线粒体或DNA片段。但现有研究又的确证实了DNA片段可以被分拣到sEV中,而不是单纯地附着在sEV的膜表面。sEV包裹DNA片段这一现象,显然影响了我们对sEV的产生、内容物的选择、包裹,及生理意义的认知。例如,sEV可以向受体细胞水平转移DNA,这甚至可能影响到基因组进化。有个别研究纯推测或通过实验揭示了DNA片段被包裹在sEV的潜在机制,但这不是全部。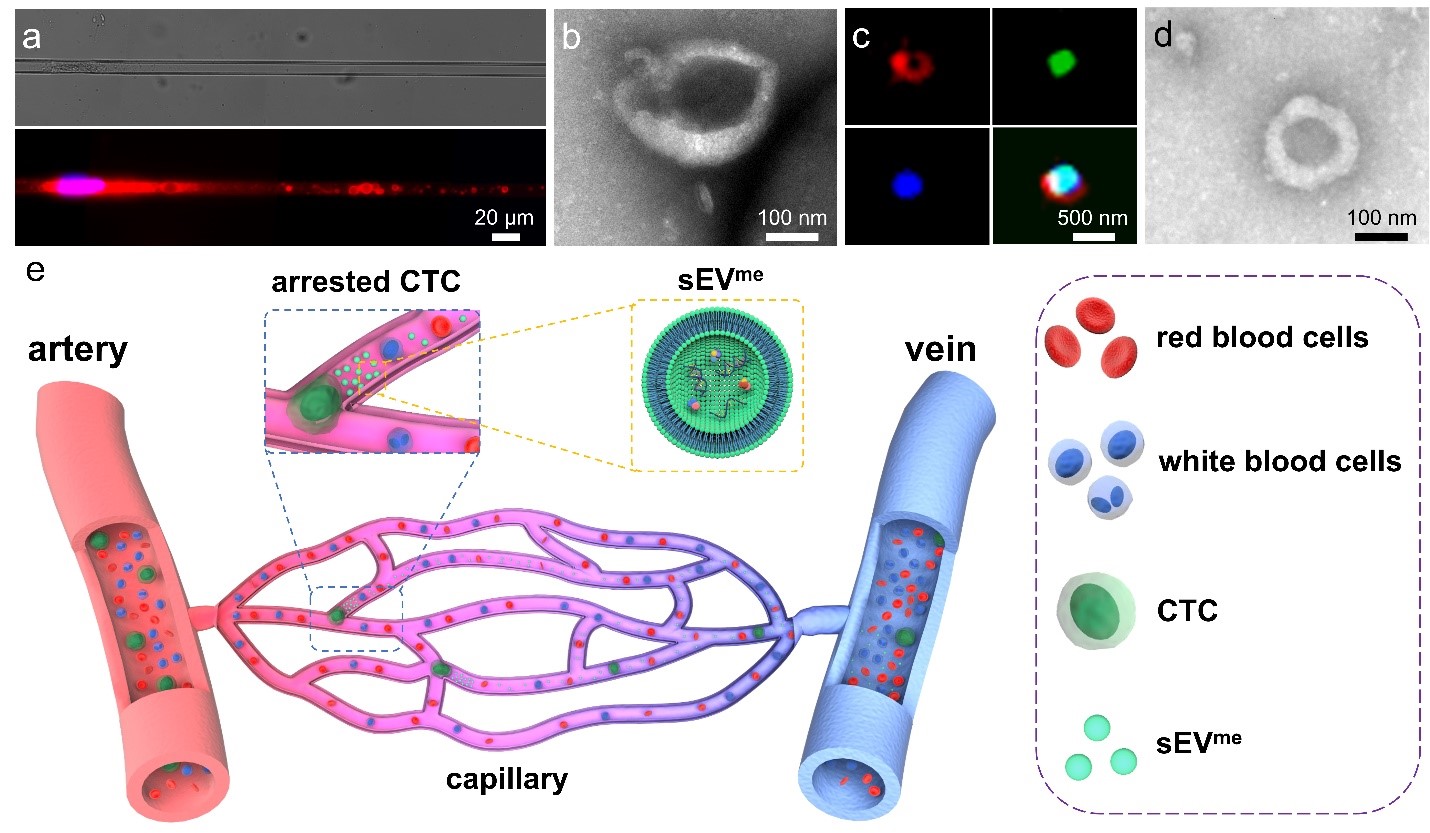
近期,British Journal of Cancer杂志的一篇前瞻性观点的文章中,研究人员推测肿瘤病人外周血中包裹有DNA片段的sEV可能来自于“卡”在毛细血管内,受机械挤压而破损的循环肿瘤细胞。作者提及,之前在仿毛细血管的微流体芯片中研究肿瘤细胞及细胞核变形时发现,“卡”在微流体通道内的肿瘤细胞,近端受到近似于毛细血管压的压力作用下,其远端能释放出大量类似EV的囊泡。这些囊泡大小从几十纳米到几微米不等。随后,按照标准的sEV分离方案,能收获到sEV样囊泡,这些囊泡被定义为通过机械挤压(mechanical extrusion)产生的sEV(sEVme)。这些sEVme 带有EV的蛋白标记物。电镜下,sEVme 和细胞自然分泌(spontaneous secretion)的sEV(sEVss)在形态上也没有差异。简而言之,sEVme 和sEVss 具有非常相似的理化特性。同时,sEVme也携带了基因组DNA片段及各种RNA分子。根据该发现,作者推测外周血中载有基因组DNA片段的sEV,部分可能来自于循环肿瘤细胞(CTC)。CTC是脱离原发肿瘤,进入血液循环中的的肿瘤细胞。CTC可随血逐流,作为肿瘤传播的种子能种植到远处器官,从而有可能导致肿瘤转移灶形成。由于CTC大一般有12-25微米大,所以90%以上的CTC在血循环中很容易“卡”在肺、肝、心肌和骨骼肌的毛细血管中。类似于在微流控芯片里那样,这些被“卡”住的CTC,极容易被其两端的毛细血管血液压力差,外部组织压力(例如肌肉收缩)破坏掉。这就意味着CTC在物理作用下可能会爆炸性地释放大量的sEVme 。另一方面,当CTC“卡”在毛细血管内,被严重挤压时,DNA片段有可能被包裹到sEVme。最新的研究表明,细胞核严重变形时,会破坏核包膜和染色体DNA的完整性,可能导致DNA片段流入细胞浆。之后,这些DNA片段再被包裹到sEVme。如果CTC通过毛细血管时,受到了机械挤压,但侥幸存活下来,这些进入到细胞浆的DNA片段也有可能被包裹进sEVss,再被释放到细胞外。这一观点能解释为什么在肿瘤患者外周血sEV中可以发现DNA片段。而在临床上,这些含有基因组DNA片段的sEV ,可能部分有助于肿瘤液体活检,同时为基于sEV DNA的液体活检提供了理论依据。这篇文章另一观点认为CTC释放的sEVme,可能促进肿瘤转移。“卡”毛细血管床中的CTC被物理挤压后,99.9%以上的CTC会破裂、死亡,仅有不到0.01%的CTC能存活下来。理论上,CTC的死亡能极大降低CTC转移播种的风险。但也未必。被物理挤压破坏掉的CTC,释放出的大量sEVme可能仍然在肿瘤转移过程中发挥重要的生物学作用。最近的研究表明,源自干细胞的sEVme 也具有一定的生物学活性,且源自干细胞的sEVme已被尝试着用于再生医学,如皮肤再生和骨骼修复。近期该课题组通过测序,进一步证明sEVme与sEVss是高度相似性。蛋白质测序数据显示,两者之间的膜蛋白相似度为~71%。RNA测序对丰度最高的前1000个小RNA的分析表明,两组之间的相似度为~65%。这些结果均提示,相较于sEVss,sEVme是有一定生物学功能的,仍能调控受体细胞。由此,CTC受挤压而释放的sEVme必然携带有大量肿瘤相关分子,进而对受体细胞施加影响。需注意的是,由于sEVme只有不到200纳米,其更很容易通过血液循环系统,进行广泛传播。调节肿瘤转移前的微生态,抑制抗肿瘤免疫,从而有利于那些顺利通过毛细血管的CTC播种、增殖。总统而已,体内sEV的形成机制可能比我们目前认识的要复杂得多,因此值得进一步研究。在与肿瘤相关的研究中,充分了解sEV的形成机制将有利于我们理解肿瘤转移并提出相应临床治疗策略。但由于sEV只有不到200纳米,缺乏特异性肿瘤蛋白标志物,以及缺乏sEV的可视化的方法,相关研究也相对困难。全文链接https://www.nature.com/articles/s41416-022-01934-zYuan Wan, 宾汉姆顿大学生物医学工程系助理教授。Yiqiu Xia,卡内基梅隆大学生物医学工程系博后Siyang Zheng,卡内基梅隆大学生物医学工程系教授。外泌体资讯网 循环肿瘤细胞受挤压后释放的小胞外囊泡有可能促进肿瘤转移吗?





