胰腺癌(pancreatic cancer,PC),是一种恶性程度极高的恶性肿瘤,因早期诊断困难且缺乏有效的治疗方法,导致预后极差,俗称癌中之王。对人类健康构成严重威胁。尽管针对胰腺癌免疫疗法的临床试验取得了长足进展,但治疗的有效比例非常低,表明免疫逃避仍是PC免疫治疗的主要障碍。目前PC免疫逃逸的机制尚不完全清楚,这极大地限制了免疫治疗的发展。因此,深入研究PC的免疫逃逸机制,对研发出有效的治疗方案有深远的意义。细胞外囊泡(EVs)作为细胞间通讯的重要组成部分,通过在细胞间运输各种生物活性分子参与肿瘤的发展,因此,发掘EVs在肿瘤免疫逃逸中的关系及作用,对探索其在肿瘤免疫治疗中的应用潜力有重大意义。
近日,台州市中心医院(台州学院附属医院)的王毅超团队作在Pharmacological Research上发表了题为“Extracellular vesicles in pancreatic cancer immune escape: Emerging roles and mechanisms”的综述论文(2022 Jul 25;183:106364)。作者们首先总结了现如今对PC认识以及其医治的困难性,介绍了PC与肿瘤免疫微环境的关系、EVs在PC免疫逃逸中作用的最新进展,总结了EVs参与免疫调节的机制,探讨了EVs在免疫治疗中的潜在应用,最后对EVs更多的发展潜力进行了展望。
综述包括以下内容:第一部分:胰腺癌的发病特征与免疫逃逸胰腺癌(PC)是一种发病隐匿,进展迅速,治疗效果及预后极差的消化道恶性肿瘤。现对PC的治疗包括手术切除与放、化疗,但由于其被发现时已晚期难以手术且对放、化疗不敏感,使PC的死亡率极高。PC的临床症状不典型,多为消化系统的常见表现,包括腹痛、消化不良等,大多数患者在病程中出现进行性黄疸、新发糖尿病、抑郁、等症状。PC的形成是由于外源性致癌因素长期作用于胰腺,引起的局部变性细胞出现异常的增生。在手术及放、化疗均不能显著改善预后的情况下,免疫治疗在实体肿瘤治疗中的广泛应用给PC的治疗带来新的思路。但在PC发生过程中会激活一种免疫逃逸机制,使免疫治疗无效。免疫逃逸是指癌细胞通过多种机制逃避这种免疫监视和消除,从而使其在体内增殖和转移,导致肿瘤进展的现象。第二部分:胰腺癌的免疫与微环境免疫系统在PC的发展过程中具有矛盾而复杂的功能。在PC的早期阶段, 宿主免疫系统可以主动识别肿瘤特异性抗原,从而激活先天和适应性免疫反应,消除转化细胞。然而,免疫压力驱动了PC的表型选择,而低免疫原性的肿瘤细胞可以在免疫反应性环境中茁壮成长。肿瘤细胞免疫原性的变化导致免疫耐受的过程称为肿瘤免疫编辑,这是一个分三个阶段的渐进过程(图1)。
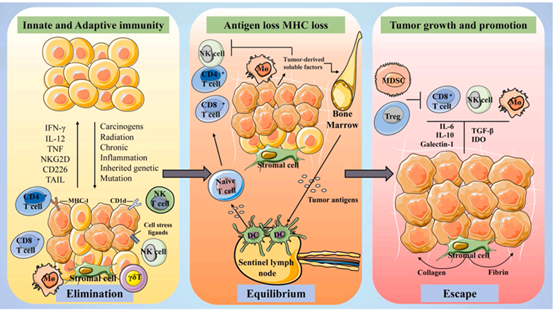
图1:免疫微环境与胰腺癌之间的相互作用可分为三个过程:消除、平衡和逃逸。消除:免疫系统通过识别肿瘤抗原来消除高度免疫原性的肿瘤。平衡:免疫压力选择免疫原性较低的肿瘤细胞,在免疫清除和肿瘤生长之间达到平衡。逃逸:肿瘤细胞通过多种机制来免疫逃逸实现恶性增殖。(图源:Chunping Liu et al, Pharmacological Research,2022)而免疫微环境主要由细胞成分、细胞因子和细胞外基质组成。各种细胞和非细胞成分之间的各种生化和物理相互作用促进肿瘤进展并产生耐药性(图2)。
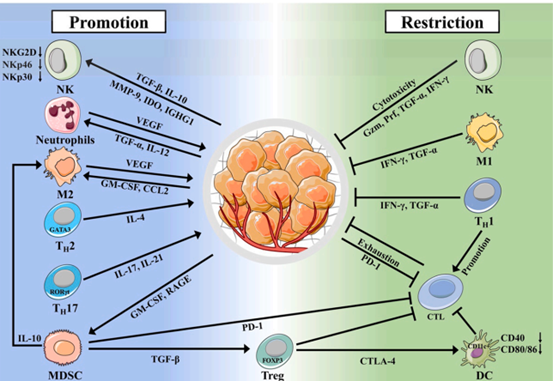
图2:胰腺癌中的免疫微环境。PC中的免疫微环境包括免疫细胞、细胞间基质和细胞因子。肿瘤细胞通过抑制免疫效应细胞或促进抑制性免疫细胞的功能,最终在PC中产生免疫抑制微环境。(图源:Yi-Chao wang et al, Pharmacological Research,2022)PC微环境(TME)也是免疫逃逸[3]的基础。一方面,间质细胞分泌大量的纤维蛋白和胶原蛋白来压缩肿瘤体积,压缩肿瘤内的淋巴管和血管,导致缺氧和灌注不足。缺氧和低灌注进一步促进TME基质中肿瘤相关因子的分泌,提供肿瘤生长、转移的所需条件,形成恶性循环。PC的特异性TME是肿瘤组织靶向药物传递的一个重要障碍,缺氧与低灌注可诱导药物外排,抑制细胞凋亡,导致耐药。另一方面,免疫细胞在TME中的功能受到严重抑制,导致癌细胞的免疫逃逸和转移。第三部分:EVs在肿瘤免疫中的作用与机制EVs是TEM中有效的细胞间通信介质,调节一系列生理、病理过程。NK细胞和巨噬细胞是参与先天免疫的重要细胞,也是肿瘤免疫微环境的重要组成部分。肿瘤来源的EVs可通过TGF-β1抑制NK细胞介导的功能。且肿瘤来源的EVs含有热休克蛋白(Hsp70或Hsp72),并通过STAT3激活[4,5]介导MDSCs的抑制活性。肿瘤相关EVs在成纤维细胞分化为CAFs并诱导基质形成中起着重要作用,有利于肿瘤生长[6]。并且还可以通过传递蛋白质来刺激成纤维细胞分化为支持肿瘤的细胞。而msc来源的EVs则可抑制肿瘤的侵袭和迁移。第四部分:由EVs衍生的细胞调节免疫逃逸的研究进展胰腺导管腺癌(PDAC)患者的预后经过很多年研究后仍不能明显改善 ,5年生存率约为10%。PDAC对各种治疗策略的耐药性是导致PDAC患者预后不良的主要障碍,与PC的免疫逃逸行为高度相关。除了内源性和外源性因素的作用外,先前的研究表明,PDAC由于其低肿瘤突变负荷和形式而增强了适应性免疫 免疫抑制性TME,其特征是MDSC浸润显著增加,缺乏cd8+T细胞和低水平的激活标记物,从而增强PC的适应性免疫。这也是过继转移的T细胞免疫功能障 碍和免疫检查点封锁治疗[7,8,9]疗效下降的标志。PC衍生的EVs被发现通过调节各种免疫过程来调节免疫监测(图3和表1)。
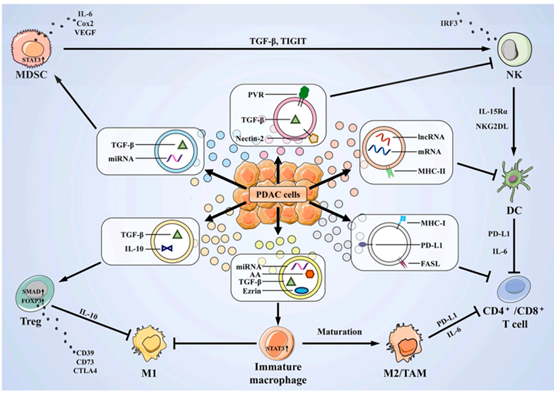
图3. EVs参与胰腺癌免疫逃逸的机制。PC衍生的细胞外囊泡通过传递蛋白质和核酸等生物活性分子来介导PC的免疫逃逸。(图源:Chunping Liu et al, Pharmacological Research,2022)
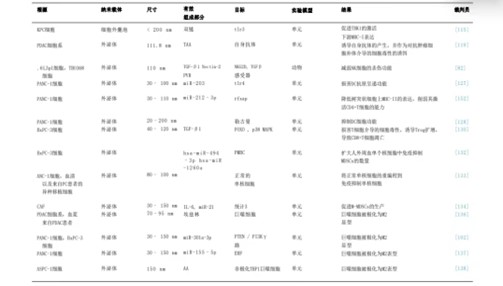
表1:细胞外囊泡(EVs)作为载体在PC中的应用综述。缩写:AA,花生四烯酸;ASPC-1,来自腹水的人胰腺癌细胞系;CAFs,癌相关成纤维细胞;EHF,E-26同源因子;M-MDSCs,单核细胞髓系来源抑制细胞;外周血单核细 胞;PVR,脊髓灰质炎病毒受体;RFXAP,调节因子X相关蛋白;STAT3,信号转导和转录激活因子3;TAAS,肿瘤相关抗原。
第五部分:EVs在PC免疫治疗中的潜在应用及发展前景EVs在PC免疫治疗中的作用被可被分为四类:(1)免疫相关生物标志物:EVs携带大量的免疫相关生物标志物,并广泛分布于各种体液中,为基于无创液体活检的PC免疫分析提供了机会。(2)肿瘤相关免疫兴奋剂。(3)药物载体与合成的纳米颗粒递送系统相比,EVs携带跨膜或膜锚定蛋白,可增强内吞作用,促进其内容物的传递。(4)免疫治疗靶点:EVs在PC免疫逃逸中的作用表明,选择性阻断或抑制特定EV亚群的功能将减轻对肿瘤免疫微环境的抑制,提高PC的免疫治疗效果。综上所述,EVs作为一种无细胞治疗策略,因其在调节肿瘤免疫微环境方面的安全性和有效性而越来越引起人们的关注。大量研究表明,EVs在提供调节PC TME的药物传递方面具有巨大的潜力。EVs影响PC进展的一些特征,揭示了它们在诊断、预后和治疗中的作用,并突出了它们调节免疫逃逸的潜力。但仍有许多问题有待解决;例如,必须开发新的方法来解决EVs[10]的异质性和标准化问题,并且,其潜在机制仍有待充分阐明。EVs具有制备简单、装载效率高、囊泡采集容易、生物相容性好、生物利用度高等优点。然而,其也有许多缺点,如不稳定性、特定的存储要求和包含的复杂性。关于EVs的生物化学还有许多悬而未决的问题,比如对其亚型的理解,以及载体选择、细胞间穿梭和与靶细胞相互作用的机制。其次,迫切需要提高和完善标准化和工业化的制备方法和分析技术。最后,EVs的高效设计仍然是一个挑战。总之,深入了解生物发生和细胞内的相互作用,以及标准化生产的发展,净化和质量控制技术的EVs,将促进其稳定生产和新的治疗方法的发展,最大化发掘其治疗PC和其他癌症的潜力。参考文献:Extracellular vesicles in pancreatic cancer immune escape: Emerging roles and mechanisms, Pharmacol Res. 2022 Jul 25;183:106364. doi: 10.1016/j.phrs.2022.106364.
外泌体资讯网 Pharmacol Res | 台州市中心医院(台州学院附属医院)王毅超等综述胞外囊泡在胰腺癌免疫逃逸中的作用与机制





