树突状细胞(DCs)分泌的细胞外囊泡(DEVs)作为DCs疫苗的替代物已进入临床I期和II期试验,显示出良好的可行性和安全性。然而由于复杂的肿瘤免疫微环境,免疫抗原呈递不足以及DEVs在患者体内动态不明等原因,其对肿瘤的免疫疗效有限。以DEVs为基础的免疫治疗与其他抗肿瘤方法相结合,产生协同的抗肿瘤免疫效应可能为DEVs的临床应用提供有效途径。近日,南开大学医学院王悦冰副教授课题组在利用DEVs免疫治疗肿瘤方面取得新进展。该团队以DCs作为生物反应器,首次高效合成兼具细胞外囊泡和聚集诱导发光(AIE)特性的仿生纳米颗粒(DEV-AIE),用于免疫协同光动力治疗,该纳米囊泡表现出良好的肿瘤抑制和肿瘤干细胞(CSCs)杀伤能力。相关研究成果以“Biosynthetic Dendritic Cell-Exocytosed Aggregation-Induced Emission Nanoparticles for Synergistic Photodynamic Immunotherapy” 为题,发表在国际权威学术期刊ACS Nano上(10.1021/acsnano.2c03597)。南开大学医学院王悦冰副教授为本文的通讯作者,南开大学医学院硕士研究生曹红梅和南开大学生命科学学院博士研究生高贺麒为本文并列第一作者,南开大学医学院为第一完成单位。该研究得到了国家重点研发计划和国家自然科学基金的资助。

基于该课题组前期细胞外囊泡的研究基础(ACS Nano,2019;ACS Nano,2020;中国发明专利: ZL 201811051433.4),利用DEVs独特的生理特性及其载体优势,该团队提出将DCs作为生物反应器,以能够引起肿瘤细胞线粒体氧化应激的AIE光敏剂作为反应物,在细胞内生物合成并胞吐高产量的新型功能化纳米疫苗DEV-AIE,用于免疫协同光动力治疗肿瘤。这种仿生合成策略不仅能够保持DEVs膜蛋白的完整性,而且实现了AIE光敏剂的高效装载。
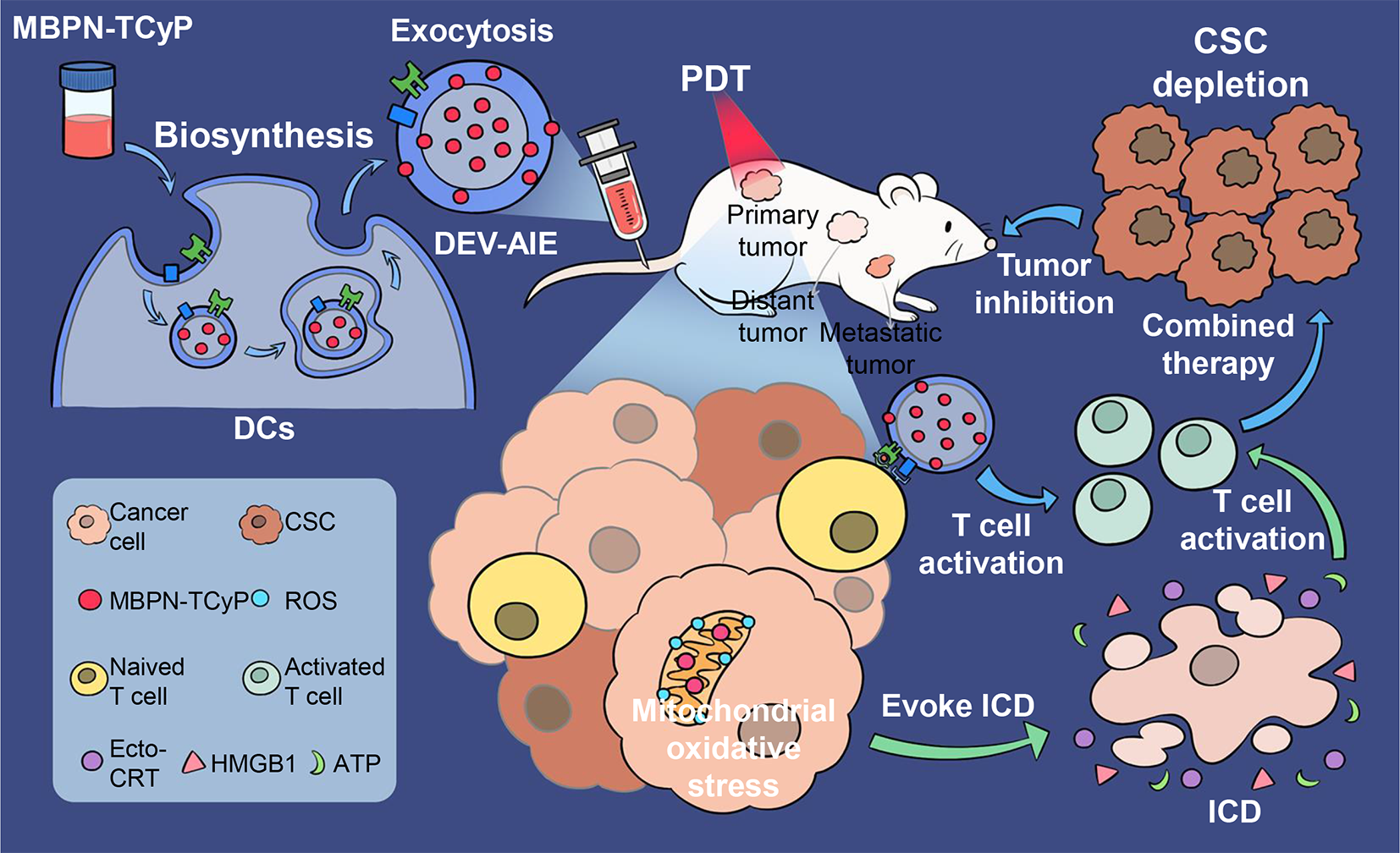
在生物电镜下,研究人员观察到,AIE光敏剂MBPN-TCyP聚集在DEVs的内部和表面,且胞吐的DEV-AIE具有与DEVs相似的杯状囊泡结构。而且,DEV-AIE具有与AIE光敏剂一致的光学性能。进一步体内外研究发现,胞外分泌的DEV-AIE不仅继承了亲代DCs的免疫调节蛋白,可直接激活T细胞;并且其高效负载的MBPN-TCyP可选择性地靶向至肿瘤细胞线粒体诱导免疫原性死亡(ICD),多途径激活了适应性免疫应答,进而有效抑制原发肿瘤、远端肿瘤和转移瘤。同时,课题组还发现,DEV-AIE能够显著杀伤4T1和CT26实体瘤中的CSCs。该研究为胞外囊泡仿生纳米药物的开发提供了一种无创、高效、简便的策略,并证明了基于DEVs的免疫治疗和AIE光敏剂介导的光动力治疗是临床抗肿瘤纳米疫苗的一个强有力方向。参考文献:Biosynthetic Dendritic Cell-Exocytosed Aggregation-Induced Emission Nanoparticles for Synergistic Photodynamic Immunotherapy, ACS Nano. 2022 Aug 12. doi: 10.1021/acsnano.2c03597.




