细胞外囊泡 (EV) 是由所有细胞类型分泌到细胞外空间的纳米级囊泡,包括大脑中的神经元和星形胶质细胞。EV在脑生理和病理过程中发挥着关键作用,例如废物清除、细胞间通讯以及将保护性或致病性物质运输到细胞外空间。来自美国内森·S·克莱恩精神病研究所的研究人员制定了一种基于碘克沙醇梯度的从脑组织中分离EV的方法,特别是揭示了除了微囊泡和外泌体的第三种EV亚型——线粒体囊泡。该标准化程序的推出,将为科学界研究这些不同类别的生物活性EV在生理环境以及神经发育和神经退行性疾病中的功能提供了宝贵的资源。相关成果以“Isolation of mitochondria-derived mitovesicles and subpopulations of microvesicles and exosomes from brain tissues”为题在8月12日的Nature Protocols杂志上在线发表。
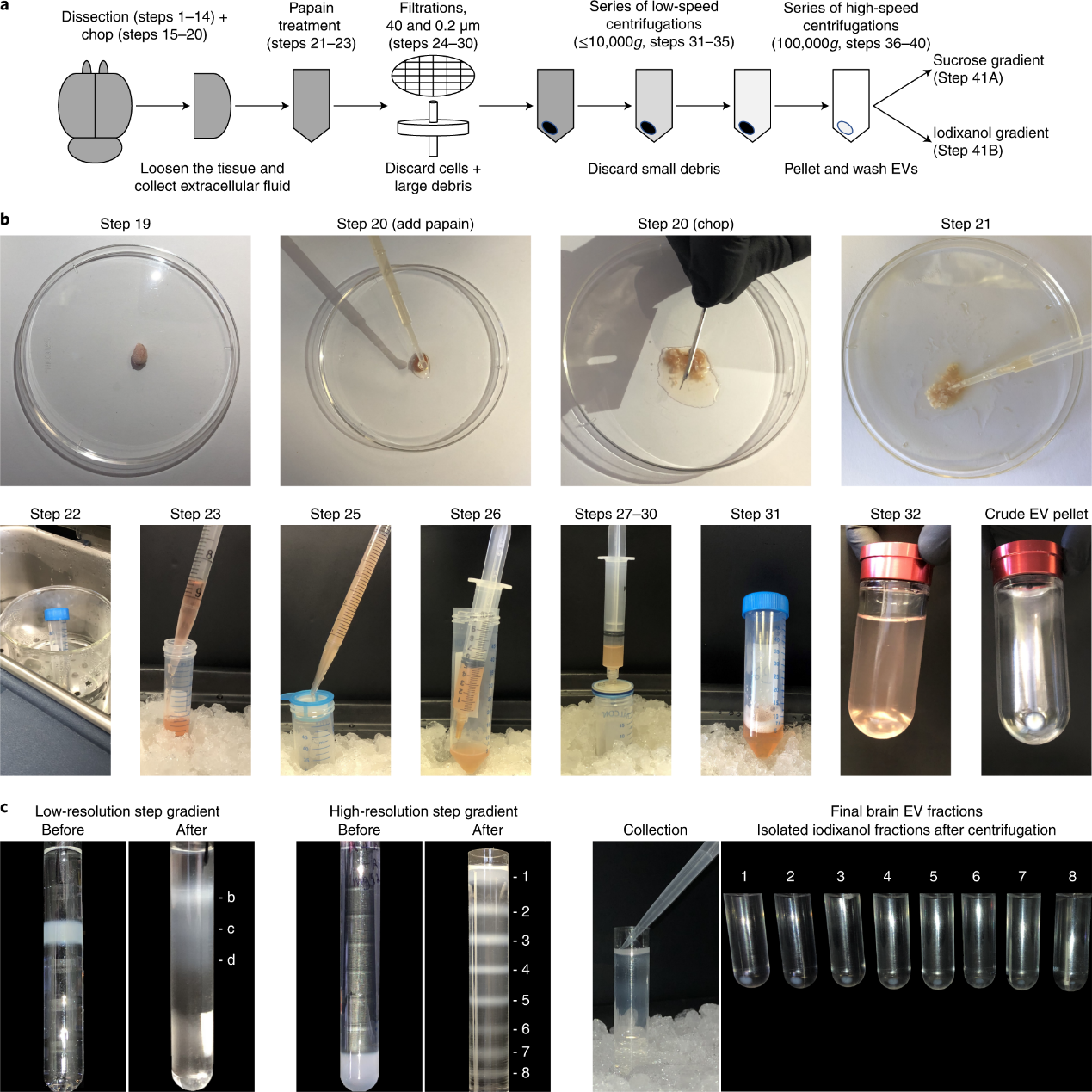
图A:将EV从右侧小鼠半脑中分离出来的程序示意图。B:脑EV分离过程中最重要步骤的代表性照片。 C:脑EV亚群分离过程中最重要步骤的代表性照片。在 200,000g 过夜超速离心前后显示,装载脑EV的蔗糖低分辨率梯度(左)和碘克沙醇高分辨率梯度(中)的比较。细胞外囊泡 (EV) 由所有细胞类型(涵盖原核生物、植物、动物及人类细胞)组成性地产生并释放到细胞外环境中。传统上认为,EV分为两个主要亚群,微囊泡(microvesicles,也被写作ectosomes或oncosomes)和外泌体(exosomes)。微囊泡是较大的 (100–1,000 nm) EV亚群,由富含胆固醇的质膜微区向外出芽产生。外泌体是较小的 (50-150 nm) EV亚群,起源于内体区室,在完全成熟的晚期内体(也称为多泡体)与质膜融合后释放。在过去的二十年里,数据表明,EV的生物活性是复杂的,因为它们一旦被受体细胞内化,就可以调节多种途径,包括炎症、细胞存活和细胞迁移。因此,EV被认为是细胞间通信的重要参与者。在脑生理学的背景下,EV通过在细胞之间传递神经营养因子而具有神经保护功能。此外,大量研究表明,EV可以在神经退行性疾病的发展中发挥关键作用。例如,EV 携带关键的致病蛋白,如朊病毒蛋白、亨廷顿蛋白及其毒性mRNA、tau、淀粉样蛋白β前体蛋白 (APP) 和 APP 代谢物,并在整个大脑中传播。因此,EV在神经退行性疾病中具有多效性作用:EV通过排出细胞内有害物质来减轻神经元压力,但也可以通过在整个大脑中运输神经毒性分子来促进脑疾病的传播。来自不同细胞内和质膜区室的EV亚群在脑细胞的稳态中具有不同的作用,因此它们对神经退行性疾病的发展有不同的贡献。因此,研究EV异质性和复杂性将揭示大脑中的生理和病理过程,并为药物成瘾和复杂脑部疾病的进展提供新的见解(如朊病毒病、阿尔茨海默病和帕金森病)。研究已经表明,在这些情况下,胞内体途径和质膜外体途径之间存在特定的相互关系。例如,研究表明,长期暴露于可卡因的小鼠大脑中发生的内体功能障碍以及唐氏综合症、阿尔茨海默病和脊髓小脑共济失调的早期阶段会影响外泌体分泌到大脑和小脑细胞外空间。相反,载脂蛋白等位基因ε4(散发性阿尔茨海默病的主要遗传风险因素)的人类和鼠类携带者的大脑中显示出相反的情况,其中外泌体分泌失调先于内体病理学。唐氏综合征中微囊泡的分泌不受影响,而线粒体生物学发生改变,可能与线粒体功能障碍有关。除了微囊泡和外泌体,研究人员发现,还存在第三种类型的EV,在细胞内来源于线粒体,命名为mitovesicle(线粒体囊泡)。在此背景下,线粒体囊泡的研究开辟了一个新的领域。人们发现,血小板释放线粒体成分,除了“细胞外游离线粒体”,还可在血液中检测到其他的线粒体个体,它比整个线粒体更小(~100-200 nm)。数据表明,这些血液中的线粒体个体是线粒体囊泡。在神经退行性变的背景下,研究脑实质中的线粒体囊泡生物学可以为识别血液中的生物标志物提供新的方向。例如,从阿尔茨海默病患者血浆中分离出的循环 EV,与没有病理的对照相比具有更高水平的线粒体mRNA (mtRNA)。鉴于线粒体损伤是阿尔茨海默病中发现的典型表型,并且鉴于线粒体囊泡含有mtRNA和mtDNA,这一证据与在大脑中的数据一致,因为在线粒体功能障碍和唐氏综合症小鼠模型的脑实质中更高水平的线粒体囊泡。在这篇文章中,研究人员给出的实验方法,将在特定的碘克沙醇梯度中将线粒体囊泡 (50–300 nm) 从其他小型EV中分离出来,从而能够对其进行识别和后续研究。研究人员详细的制定了一个标准化的方法,用于从小鼠和人类大脑中可靠和一致地分离 EV(包括线粒体囊泡),只需要具有基本实验室经验的工作人员在27小时内就可以分离完毕。该方法包括对脑组织进行温和的细胞外基质消化、一系列过滤和离心步骤以纯化 EV,以及基于碘克沙醇的高分辨率密度梯度梯度,可分离不同的 EV 种群,包括线粒体囊泡。研究人员还制定了详细的下游流程,用于纳米分析、电子显微镜和蛋白质印迹对脑 EV制剂进行表征和分析,以及用于测量线粒体囊泡的ATP动力学。此外,将这种新颖的基于碘克沙醇的高分辨率密度阶梯梯度与先前描述的基于蔗糖的梯度进行了比较。尽管回收的总EV的产量相似,但与基于蔗糖的梯度相比,基于碘克沙醇的梯度更好地分离不同的EV亚群,包括微泡、外泌体和线粒体囊泡的亚群。该技术可以在正常生理过程和病理性脑条件下(包括阿尔茨海默病和帕金森病等神经退行性疾病)对脑EV亚型进行定量、高度可重复的分析。

图:从碘克沙醇梯度组分8中采集到的线粒体囊泡的代表性电子显微照片。参考文献:Isolation of mitochondria-derived mitovesicles and subpopulations of microvesicles and exosomes from brain tissues. Nat Protoc. 2022;10.1038/s41596-022-00719-1




