小细胞外囊泡(small extracellular vesicle,sEV)作为细胞间通讯的重要媒介,参与肿瘤的形成、转移过程。因此,sEV成为液体活检与疾病辅助治疗监测的重要生物标志物,在肿瘤诊断和治疗监测中起着重要作用。sEV存在体积小、丰度低的特点,而常用的超高速离心方法存在分离效率较低、无法筛选性分离等问题,所以提升sEV的分离检测效率至关重要。目前,优化sEV分离提取的重点需要简化sEV提取过程,摆脱对超高速离心机等大型仪器的依赖。因此,开发提取效率高、无需大型仪器的sEV富集分离方法具有重要意义。近日,重庆大学刘国祥教授、罗阳教授、顾玮副研究员团队在Analytical Chemistry上发表了题为“Ultracentrifugation-free Enrichment and Quantification of Small Extracellular Vesicles”的文章(doi: 10.1021/acs.analchem.1c05491)。该研究构建了一种基于可控自组装DNAzyme的小细胞外囊泡分离检测策略,在不借助超高速离心机的情况下,结合普通离心即可对所形成sEV团簇进行有效富集,进一步在自组装DNAzyme的可控快速剪切下实现sEV簇的切割分散和同步定量检测,整个反应在1.5小时内完成。该体系可快速有效富集、分离和检测sEV,在实现sEV分离检测的同时,为sEV的疾病早期诊断和工程化应用提供新思路。于兴乐、陈晓辉为文章的共同第一作者,罗阳、刘国祥、顾玮为文章的共同通讯作者。

受启发于DNAzyme的生物传感平台具有多功能性、灵敏性和稳定性的优势,这项研究通过整合DNAzyme技术与核酸适配体技术,构建了一种不依赖超高速离心机等大型仪器的sEV分离策略,具体为:分别设计了连接有CD63核酸适配体的底物核酸探针链(Substrate链)与连接有胆固醇分子的DNAzyme核酸探针链(原理图1a)。该结构可与金属镁离子触发识别剪切反应,引发核酸序列空间结构中特异位点切割(原理图1a)。
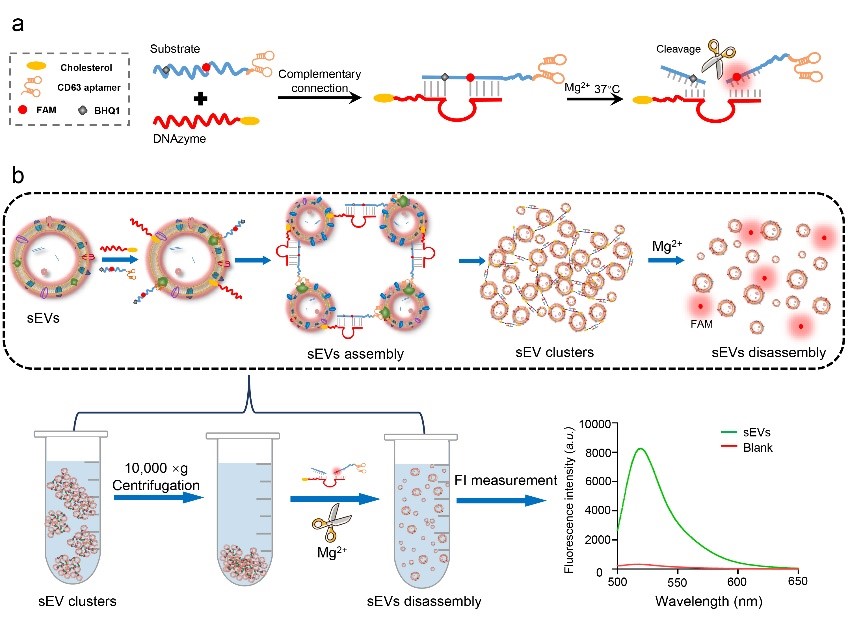
图1. 基于金属离子控制的DNAzyme体系裂解的sEV富集分离和定量检测原理图(a)DNAzyme结构的形成和由镁离子引发的裂解示意图(b)DNAzyme探针与底物Substrate探针杂交后sEV富集、分离和定量检测原理图该系统可以将单个游离的纳米级别的sEV转化为能通过普通离心分离的sEV团簇。在镁离子的存在下该检测体系发生特定位点的切割,使得sEV团簇可以重新被裂解并释放单个游离sEV(原理图1b)。同时,在裂解释放的过程,通过切割标记了荧光基团(FAM)和淬灭基团(BHQ)的核酸探针,释放荧光基团产生信号,实现了对sEV的定量分析(原理图1b)。
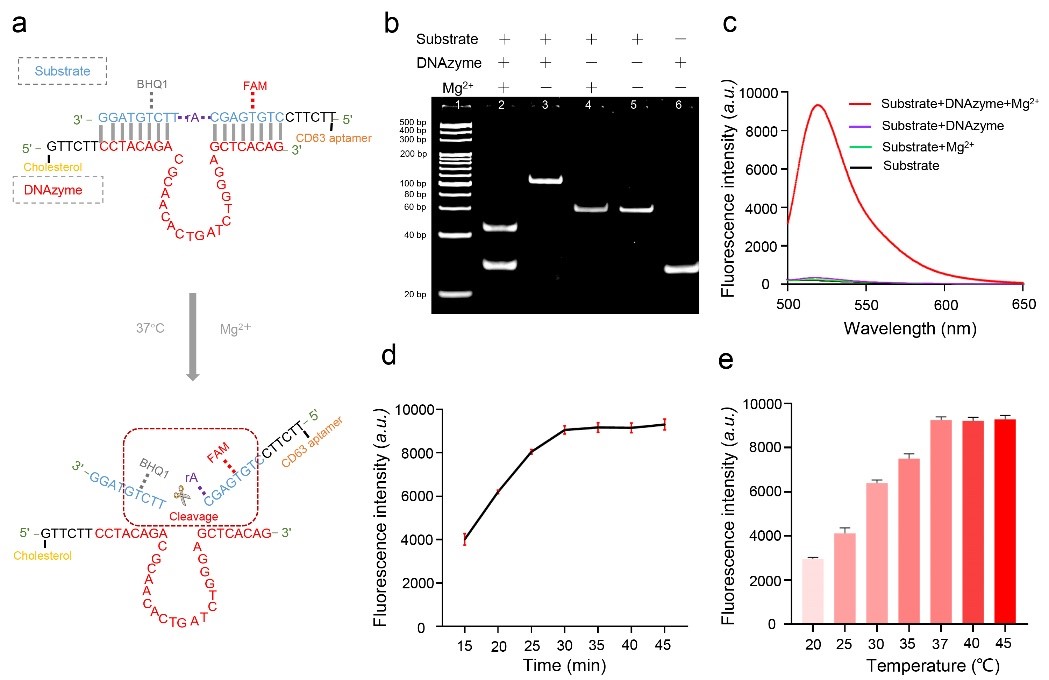
图2. DNAzyme可控裂解的原理与实验分析(a)DNAzyme反应体系链与底物链杂交与裂解示意图(b)DNAzyme体系的PAGE电泳结果(c)Mg2+介导的底物链荧光释放(d)不同反应时间下体系的荧光强度变化趋势(e)不同温度下样品的荧光强度变化趋势为进一步验证DNAzyme触发的空间组合与裂解效果。DNAzyme和底物把它串起来能够形成空间补体的DNAzyme结构(图2a)。形成的双链配合物在加入Mg2+后可以被裂解,从而触发FAM荧光团与BHQ1淬灭基团间的分离。DNAzyme结构在添加Mg2+后可以有效对底物特定位点进行切割,因此观察到一条长度为45 bp的新条带,与此同时,荧光检测也表明了520 nm处FAM荧光团和BHQ1淬灭剂之间的高效分离(图2b, c)。综上所述,该研究所设计的探针可以聚集形成DNAzyme三维结构,在Mg2+的存在下快速裂解。同时,作者优化了检测的最优Mg2+浓度为40 mM,反应温度为37℃ (图2d, 2e)。接下来,作者研究这些探针是否会触发sEV聚合形成sEV集群(图3a)。在sEV孵育这两个探针之后样品放置0.5 小时后,共聚焦图像共定位表征表明sEV有聚集成sEV簇的趋势(图3b)。因此,sEV簇可通过普通离心进行分离。接下来对该体系的再分散能力进行验证,加入Mg2+后可有效触发互补探针的切割和sEV簇有效分离(图3c, d)。同时随着sEV的数量增加,FI与sEV浓度呈指数线性相关。该方法检测范围为102-107颗粒/μL。根据该方法计算的检出限为54颗粒/μL(图3e)。
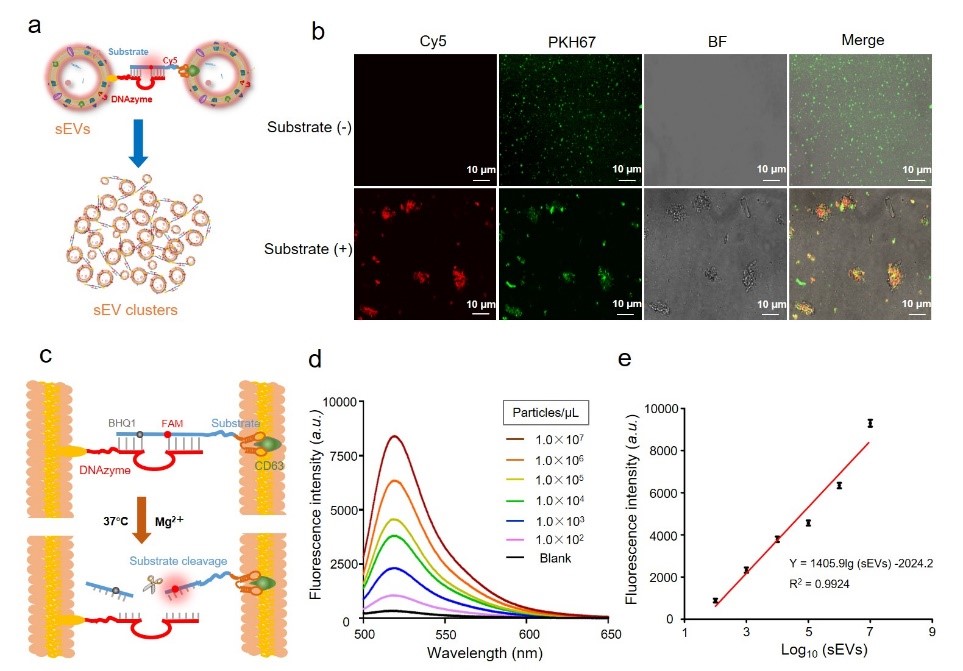
图3. DNAzyme互补捕获形成sEV簇验证(a)锚定DNAzyme链与底物链共聚合sEV的原理示意图(b)共聚焦显微镜分析sEV聚集实验结果。sEV膜用PKH67标记(绿色),底物链采用Cy5进行标记(红色)。比例尺=10 μm(c)sEV膜上DNAzyme探针体系锚定聚集与裂解分散示意图(d)本体系在不同sEV浓度下的检测效果(e)该体系在不同sEV浓度的定量分析的标准曲线。最后,作者对该策略分离的sEV形态结构、生物学功能进行验证及临床样本分析。透射电子显微镜和蛋白印迹分析表明,该方法提取的sEV仍然保持完整的膜结构并保留特异性蛋白(图4a, b)。与传统的超高速离心方法对比,该策略分离的sEV粒径分布相似(图4c, d)。下面进一步验证该研究方法提取的sEV的生物学功能是否完整,通过细胞划痕实验表明DNAzyme策略提取sEV与传统超高速离心方法提取的sEV具有相似的生物学功能(图4e)。在验证了该研究方法对细胞系来源样本中sEV分离的可行性后,进一步在实际临床样本中探究了该策略分离sEV的应用效果。该策略对临床样本中sEV定量分析的对比实验,将10份临床标本分别用DNAzyme方法和超高速离心法分离进行分离和定量sEV(NTA数据分析)。该实验结果表明(图4f, g),该策略可不依赖于超高速离心机,对血浆样本中sEV进行分离定量分析。
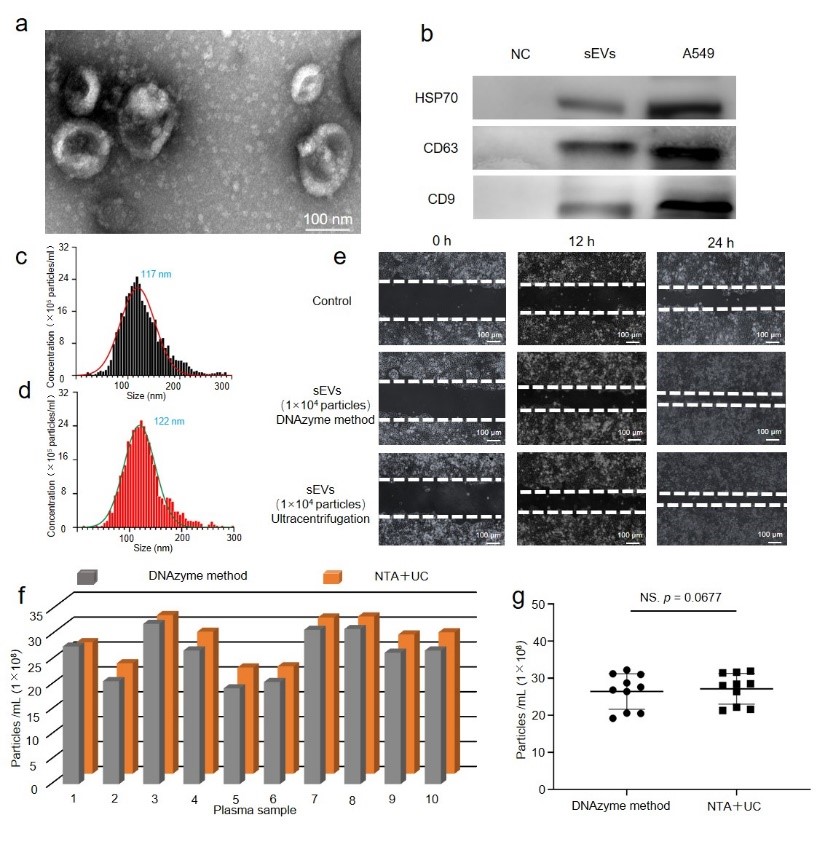
图4.聚集后分离sEV的表征(a)sEV透射电镜分析。比例尺=100 nm(b)分离的sEV代表性蛋白表征。(c, d)sEV的NTA粒径分析(e)通过细胞划痕测试sEV生物学功能分析比例尺=100 μm(f, g)对10例临床样本,分别用本策略富集后分离和定量sEV与超高速离心NTA方法的对比。该研究建立了一种可以同时高效分离和检测sEV的DNAzyme体系,为sEV的高效富集和精确定量提供了一种技术策略,在实现sEV的分离检测的同时,为sEV在疾病检测诊断和治疗中的应用提供研究基础。通讯作者简介

罗阳重庆大学医学院教授,公共实验中心主任,国家杰出青年科学基金获得者,国家特支计划青年拔尖人才,重庆市五四青年奖章获得者。先后获国家科技进步二等奖、重庆市技术发明一等奖、重庆市产学研创成果一等奖、“十一五”军队医学科技重大成果奖、军队科技进步二等奖等省部级以上奖项10余项。主要研究方向为疾病早期监测预警,主要包括POCT血型快速检测、CRISPR-Cas系统超敏检测技术、胞外囊泡(EVs)高效分离与原位检测技术以及新型纳米医学诊断技术。在Sci Transl Med,Nat Commun,ACS Nano,Adv Funct Mater,Trends Biotechnol,J Am Chem Soc 等CNS子刊和顶刊发表高水平学术论文50余篇。申报国际PCT专利6项,获国家发明专利授权20余件。

刘国祥重庆大学医学部主任、医学院院长/教授、主任医师、博士研究生导师。博士学位,教授,主任医师,现任重庆大学医学部主任、医学院院长,兼任重庆市医学会副会长。曾任第三军医大学附属西南医院呼吸内科主任医师、教授、博士生导师等职务。长期致力于呼吸系统疾病诊治和研究,在呼吸系统慢性病治疗和肺癌研究方面有较深的造诣,先后获得省部级以上科研课题10余项,包括国家自然科学基金面上项目4项,取得省部级二等奖以上成果奖7项,在国内外公开刊物上发表学术论文近100篇。作为研究生导师,先后培养博士和硕士生20余名。

顾玮外科学(野战外)博士学位,毕业于第三军医大学(现陆军医军医大学),现为重庆大学医学院副研究员。长期从事严重创伤患者并发脓毒症的早期诊断方法研究,深入探讨了遗传背景与创伤患者并发脓毒症的关系,并着重研究了miRNA、NETosis在脓毒症进程中的作用。曾获得“总后勤部科技新星”人才称号,现为中华医学会急诊医学分会创伤学分组委员,重庆市医学会创伤学专委会委员,重庆市医学会临床流行病专委会委员,中国医学装备协会现场快速检测(POCT)装备技术分会常委。中华医学会创伤学分会“中华创伤医学创新奖”获得者。以第一作者、通讯作者发表SCI论文15篇,参编论著4部。获得发明专利授权3项,实用新型专利1项,软件著作权2项。主要研究成果获重庆市自然科学一等奖(2013)和国家科技进步二等奖(2016)。目前主持国家自然科学基金面上项目、重庆市基础研究与前沿探索专项等多项课题。参考文献:Ultracentrifugation-free Enrichment and Quantification of Small Extracellular Vesicles.Anal Chem. 2022. DOI: 10.1021/acs.analchem.1c05491
外泌体资讯网 Anal Chem | 重庆大学刘国祥教授/罗阳教授/顾玮副研究员团队:一种可控自组装的小细胞外囊泡富集分离检测策略




