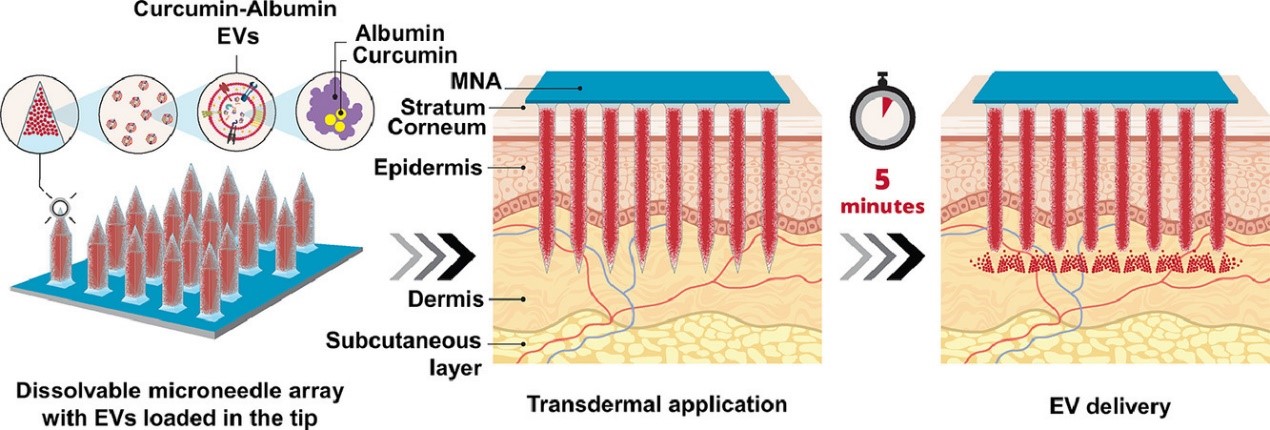
姜黄素对炎症性疾病的治疗益处已得到证实,然而姜黄素作为临床治疗剂的功效由于其在体内的低溶解度和低稳定性而受到阻碍。来自美国卡内基梅隆大学的研究人员发现,使用可溶性微针阵列 (dMNAs) 局部递送由姜黄素-白蛋白包装的细胞外囊泡可以有效维持药物稳定性,并有效抑制皮肤炎症。该研究发表于Acta Biomaterialia杂志上。
在过去的三十年中进行的临床前研究表明,姜黄素具有广泛的治疗益处。姜黄素是一种源自姜黄的天然低分子量多酚,具有强大的抗炎、抗癌和抗氧化活性。临床试验分析了姜黄素对结直肠癌、胰腺癌、乳腺癌和多发性骨髓瘤的药代动力学和有效性,并证明了姜黄素的疗效和安全性。因此,姜黄素作为各种疾病的治疗剂具有极好的潜力,包括癌症、自身免疫性疾病、囊性纤维化、阿尔茨海默氏症和疟疾。不幸的是,姜黄素的低溶解度、生物利用度和体内稳定性阻碍了其作为临床治疗剂的功效。姜黄素是一种疏水性分子,在水溶液中溶解度低。当口服给药时,姜黄素在肠道pH 值下降解并迅速代谢。同样,当全身静脉注射到血液中时,会在几分钟内降解并快速代谢,导致血液循环半衰期短。这项研究的重点是将姜黄素输送到皮肤微环境中,以治疗皮肤病,包括炎症性皮肤病和皮肤癌。最近的研究表明,姜黄素的局部应用可以为治疗各种皮肤病带来潜在的益处。研究人员在小动物模型中评估了局部施用姜黄素以促进伤口愈合和治疗皮肤病。尽管姜黄素是一种小分子 (MW=368 Da),但由于其疏水性,即使与二甲基亚砜 (DMSO) 等皮肤渗透促进剂一起使用,其通过皮肤层的渗透性也很差。此外,姜黄素在水性皮肤微环境中缺乏稳定性及低摄取,对通过局部应用达到治疗有效剂量提出了挑战。为了解决姜黄素局部应用于皮肤的这些挑战,人们已经探索了基于纳米颗粒的递送系统和皮肤渗透增强剂,但效果有限。白蛋白作为姜黄素的载体,也被研究提高其生物利用度和稳定性。白蛋白是最丰富的血浆蛋白,用于携带生物分子货物,包括血液中的营养物质、代谢物、激素和其他蛋白质。白蛋白固有的生物相容性、多结合位点和低毒性使其成为疏水药物的独特药物载体。这促使其在临床试验中作为几种药物的载体。递送姜黄素的另一种方法是使用细胞外囊泡 (EV) 作为递送载体。 EV 是天然存在的细胞分泌囊泡,由基于磷脂的双层膜结合,并装饰有多种配体和表面货物。在体内,它们的主要功能是将生物分子从亲代细胞转运到受体细胞。生物分子要么封装在EV腔中,要么与 EV膜表面相关联。鉴于其固有的携带生物分子信号货物的能力,EV越来越被认为是外源性药物输送的潜在候选者。这些天然载体保护它们的货物免受酶降解并促进有效的细胞内化。EV 已被用于递送疏水性药物、抗癌药物、酶、microRNA 和生长因子,一些基于 EV 的疗法目前正处于临床试验阶段。之前的工作已经探索了使用EV作为姜黄素的递送工具。然而,这些研究并没有有效地说明姜黄素的在EV中的包封效率,也没有证明姜黄素长期稳定性的有效改善。姜黄素与EV膜的脂质双层的非特异性可逆结合是可能的原因。EV 作为药物输送载体相关的一个关键挑战是在体内实现靶向输送。一种有效地将药物和其他生物活性物质输送到皮肤的范例是可溶性微针阵列 (dMNAs)。MNA已成为药物、病毒载体、蛋白质、核酸和细胞靶向皮肤递送的有效手段。 MNA 有数十到数百个微针从一个共同的基座上突出。在可溶性 MNA 中,递送的生物货物与凝胶形式的水溶性聚合物混合或位于同一位置,然后通过形成和干燥凝胶来制造阵列,从而产生载药的 dMNA,它们可以穿透皮肤表层而不会失效,并溶解在皮肤微环境中。该研究团队已经证明了dMNA 在靶向和可重复地递送各种药物、疫苗、病毒载体和蛋白质方面的有效性。迄今为止,尝试使用dMNA提供EV或姜黄素的研究很少。一种基于角蛋白的可拆卸微针阵列贴片,该贴片由由透明质酸 (HA) 碱支持的角蛋白水凝胶微针制成,以提供间充质干细胞衍生的EV以促进头发生长。然而,这些研究仅关注MNA递送的姜黄素的体外稳定性和生物活性。虽然有研究认为明胶甲基丙烯酰MNA可以传递姜黄素,但其仅分析了明胶甲基丙烯酰的生物相容性,而未评估递送的姜黄素的生物活性。在这项研究里,研究人员认为,白蛋白结合和EV)封装的混合姜黄素载体可以有效解决姜黄素递送的当前挑战。使用可溶性微针阵列 (dMNAs) 局部递送姜黄素-白蛋白包裹下的EV (CA-EV) 可以有效控制体内皮肤炎症。温和的超声处理用于将姜黄素和白蛋白封装到 EV 中,并将所得的 CA-EV 集成到尖端负载的dMNA 中。体外和体内研究评估了dMNA 递送的 CA-EV 的稳定性、细胞摄取和抗炎生物活性。CA-EVs 中的姜黄素在体外的稳定性至少比初始姜黄素或不含白蛋白的姜黄素-EVs 高5倍。将 CA-EV 加入dMNA并不会改变它们的细胞摄取或抗炎生物活性。嵌入dMNA的CA-EV在室温下储存12个月时仍保持了生物活性。在大鼠和小鼠模型中,dMNA传递的CA-EV抑制并显著减少了脂多糖和咪喹莫特引发的炎症。因此,CA-EV 的 dMNA 递送有可能成为炎症性皮肤病的有效局部递送策略。因此,研究人员介绍并评估了一种针对姜黄素的皮肤靶向递送系统,该系统结合了白蛋白结合、EV封装和dMNAs递送。在体外, CA-EV抑制并逆转了LPS触发的炎症转录因子 NF-kB 的表达。CA-EV与dMNA的集成不会在物理上或功能上影响EV活性。重要的是,dMNA在室温下将EV的储存稳定性延长至12个月,而其生物活性的损失最小,并证明 dMNA 在小鼠和大鼠模型中可有效阻断和逆转体内皮肤炎症。参考文献:Skin-Targeted Delivery of Extracellular Vesicle-Encapsulated Curcumin Using Dissolvable Microneedle Arrays. Acta Biomater. 2022 Jul 6:S1742-7061(22)00392-0.