细胞外囊泡(EV)是细胞分泌的脂质双层包裹的颗粒。这些细胞来源的天然EV (natural EV, nEV)可用作药物载体来递送药物。与胶束、脂质体、聚合物纳米颗粒相比,nEV作为天然的递送系统,具有低免疫原性。还可与受体细胞膜融合,避开溶酶体吞噬,将药物直接输送到细胞质中,从而显著提高蛋白、核酸药物的输送效率。此外,干细胞分泌的nEV携带有母体干细胞的蛋白、核酸,目前也被尝试用于组织修复和再生。nEV用于药物递送及组织修复再生的前景良好,但nEV的自然产率极低。为了获得足够数量的nEV,需要大量的细胞和较长的培养周期,导致高生产成本,进而影响相关临床转化。近年来研究发现,通过破坏细胞(如机械挤压、超声、冻融等处理),可获得纳米尺寸的,外观及结构类似于nEV的囊泡(cell-derived nanovesicles, CNV)。但CNV的产率是nEV的50-100倍,生产成本不到nEV的10%。作为nEV的廉价替代品,CNV在药物递送和再生医学中的作用也已得到证实。但一个基本问题尚未被确认,即CNV和nEV到底有多相似?现有研究仅仅证明两者都是纳米级的脂质双层封闭囊泡,都携带经典的EV蛋白标记物。但两者携带的蛋白、核酸有多相似,还未有相关研究。近日,宾汉姆顿大学万源和南京医科大学附属无锡人民医院毛文君课题组,在ELSEVIER旗下的学术期刊Extracellular Vesicle上发表文章,研究者基于高通量测序对两者的蛋白及小RNA(small RNA, smRNA)进行了比较(图1)。同过往研究结论一样,该研究证实nEV和CNV在大小并无显著区别,蛋白印迹也发现两者都携带经典EV蛋白标志物。一些参与免疫调节的蛋白,如CD55, CD44, CD5,MHC-I等,均在两者中检测到(图2)。nEV的排他性标志物,如细胞色素C,钙联结蛋白,组蛋白,在nEV中检测不到。挤压获得的CNV携带有微量细胞色素C,但未见钙联结蛋白和组蛋白。后续的蛋白质谱分析中也为发现钙联结蛋白和组蛋白。
图1 实验流程
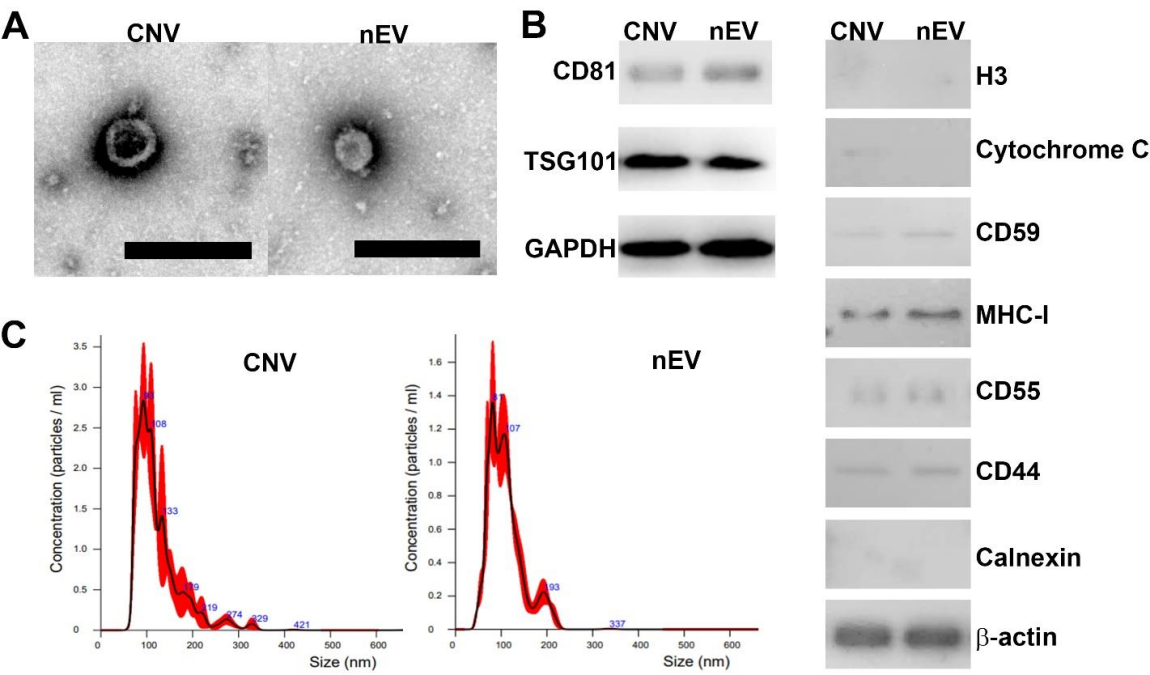
图2 nEVs和CNVs特征蛋白质谱分析发现MDA-MB-231细胞来源的CNV和nEV,总蛋白(膜蛋白及包裹在囊泡内的蛋白)的近似度约21%(图3)。 需要提醒的是,在比较蛋白表达近似度时,一般认为~60%近似度即有高度相似性。nEV组内三个生物学重复样品之间的近似度分别为66%,而CNV的组内样品间近似度则有79%。接着课题组培养9个不同肿瘤细胞系,并分别收集了nEV和CNV。利用核酸标记的抗体结合二代测序技术,来定性定量检测181种囊泡膜蛋白。结果发现,181种膜蛋白在nEV与CNV之间的近似度有71%(图4)。
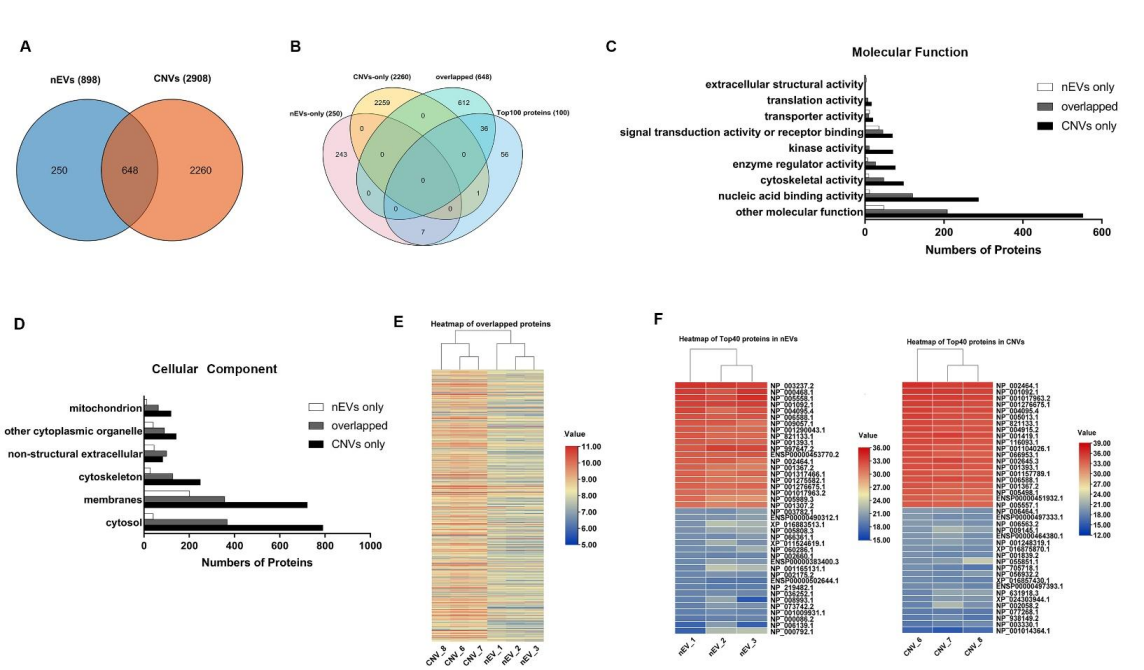
图3 nEVs和CNVs来源的蛋白质谱分析
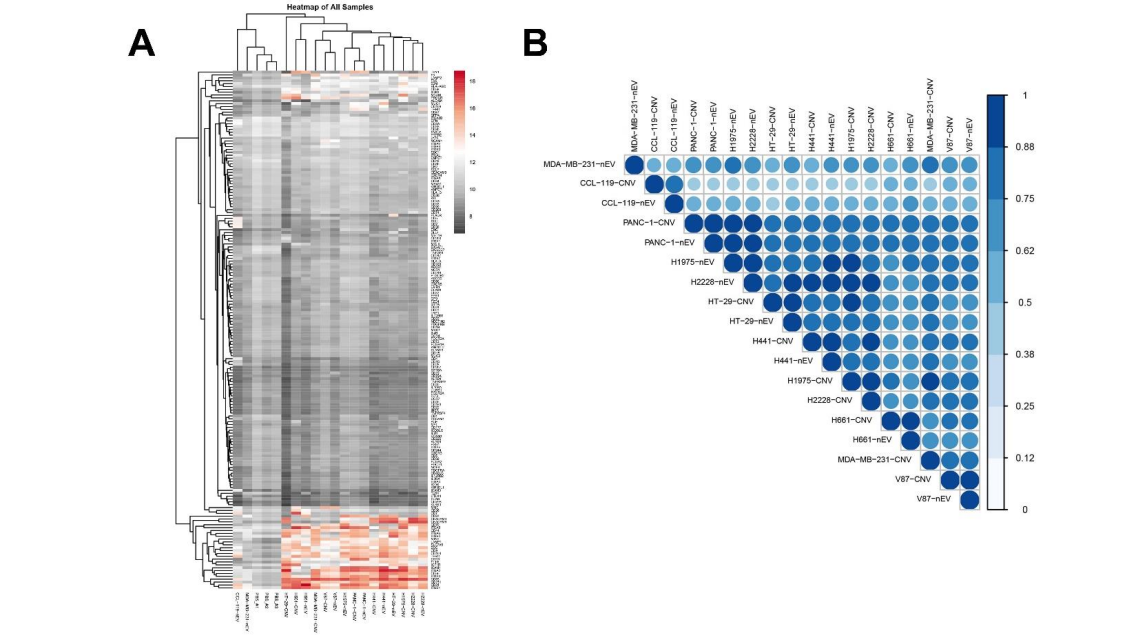
图4 9个不同肿瘤细胞系来源的nEVs和CNVs囊泡膜蛋白检测二代测序比较了两组间smRNA的表达差异(图5)。单单比较smRNA种类,nEV和CNV近似度超过95%。接着对nEV和CNV中前1000个smRNAs表达量进行分析,发现这1000个smRNA在两组之间有65%的相似性。nEV组内五个生物学重复样品之间的批次间差异为5.4%,CNV组内批次间差异为9.3%。
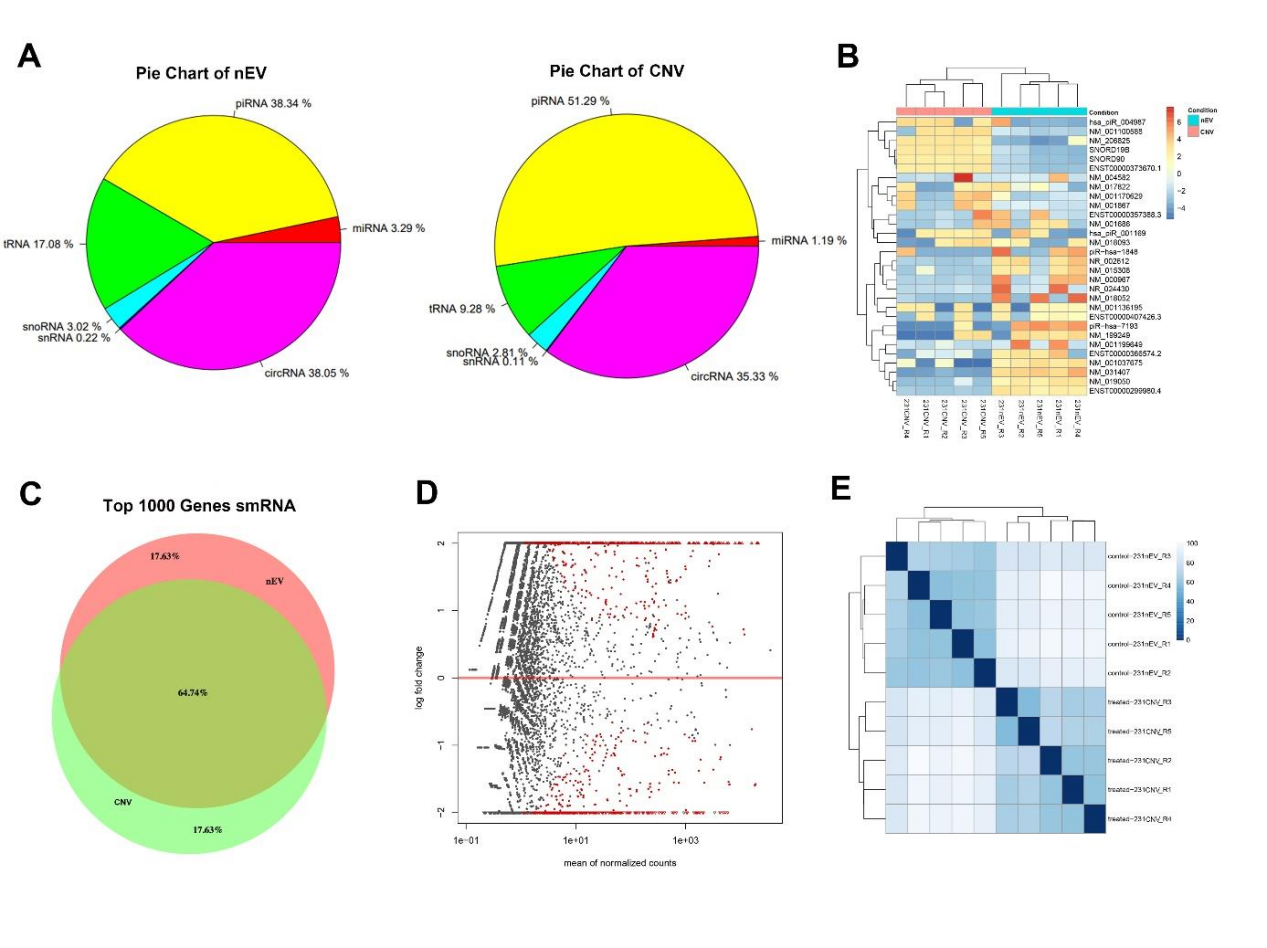
图5 nEVs和CNVs间smRNA表达差异结合以上结果,研究人员推断当CNV用作药物载体时,其内部蛋白会被清空,被药物取代,但膜蛋白可被保留。基于CNV和nEV有高度近似的膜蛋白组分,CNV可能较好替代nEV用于载药。当CNV用于组织修复再生时,21%的总蛋白近似度及65%的smRNA近似度,也提示CNV具有可观的生物学活性。该研究结论大体证实了过往研究报道的的CNV可用于载药及组织修复再生。参考文献:Yi Wen#, Qin Fu#, Ashley Soliwoda, Sheng Zhang, Mingfeng Zheng, Wenjun Mao*, Yuan Wan*.Cell-derived nanovesicles prepared by membrane extrusion are good substitutes for natural extracellular vesicles.Extracellular Vesicle,Volume 1,2022,100004.(https://doi.org/10.1016/j.vesic.2022.100004)





