自2019年爆发以来,SARS-CoV-2引起的新冠肺炎已造成5亿多人次感染,6百多万病例死亡,严重影响国际医疗、经济、社会体系。目前,全球已经有36种被FDA紧急批准使用的疫苗,包括mRNA疫苗、灭活疫苗以及蛋白疫苗等。但是,这些投入使用的疫苗基本以肌肉注射为主,多诱导系统性体液免疫。伴随新冠病毒的高度变异,现有肌肉接种式疫苗的中和能力被大幅度削弱,难以保证提供有效保护。针对新冠病毒感染机体的机制,北卡罗来纳州立大学程柯教授团队构建了SARS-CoV-2的RBD抗原修饰的人源肺球细胞外泌体,开发了一种可于室温稳定存储运输、雾化吸入式的新冠疫苗。相比于肌肉接种型疫苗,该疫苗可提供额外两层保护:呼吸道黏膜免疫以及肺部T细胞免疫,使其有能力在新冠病毒主要入侵部位提供多重保护。相关研究成果近日发表在《Nature Biomedical Engineering》期刊上(参考文献1)。
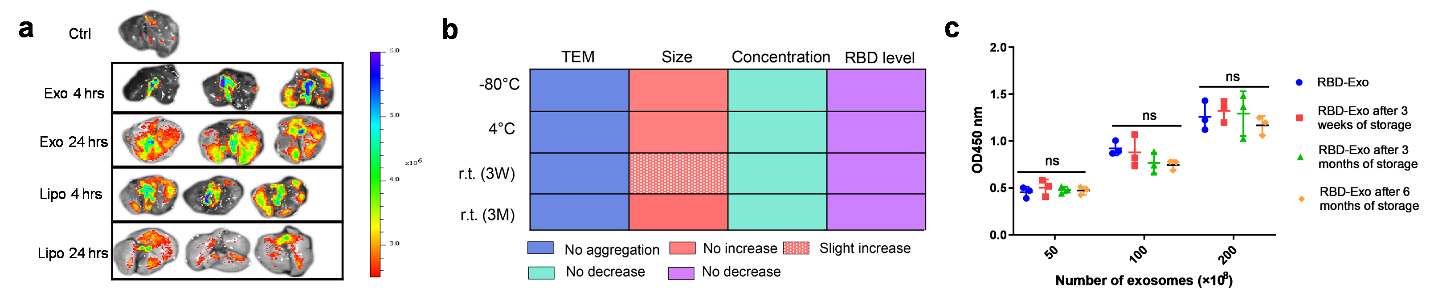
程柯教授团队前期开展了自体肺球细胞治疗肺纤维化的临床研究(NCT04262167)。在此基础上,该团队进一步发现人源肺球细胞衍生的外泌体(Exo)雾化吸入后,表现出比脂质体(Lipo)更优异的肺部滞留时间及分布(图1a)。基于此,该团队创新性的应用外泌体作为疫苗载体,通过在其表面修饰新冠病毒刺突蛋白的受体区域(RBD),制备出病毒样颗粒疫苗(RBD-Exo)。该疫苗具有高稳定性,室温保存三个月仍保留着原本的形貌、尺寸、浓度以及RBD抗原浓度(图1b)。此外,该疫苗符合ICH加快实验(40°C±2°C / 75%RH±5%RH)测试标准(图1c)。
图1:(a)外泌体和脂质体在小鼠肺组织的分布;(b)RBD-Exo疫苗的室温稳定性;(c)RBD-Exo疫苗的ICH测试实验。
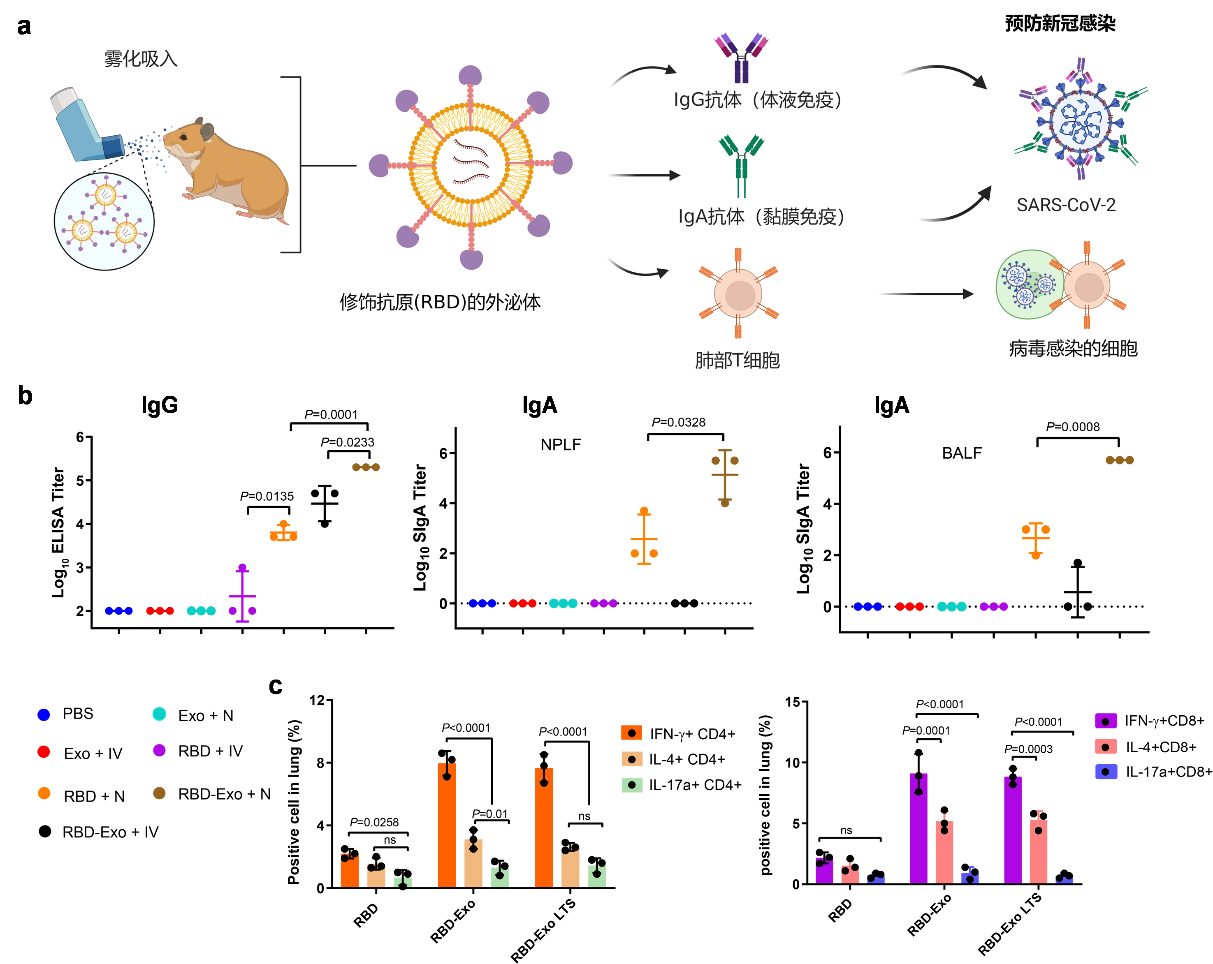
基于外泌体的内源性、天然的同源靶向能力,该RBD-Exo疫苗经雾化吸入后在呼吸道及肺组织具有更长驻留时间。除了诱导系统性体液免疫产生RBD特异性IgG抗体,该疫苗可在上呼吸道(NPLF)及下呼吸道(BALF)诱导高效的黏膜免疫,产生RBD特异性IgA抗体;同时激活肺部CD4+辅助性T细胞、CD8+ 细胞毒性T细胞,并诱导Th1偏向的免疫应答,在新冠病毒侵入人体的第一感染部位提供有效保护(图2)。
图2:RBD-Exo疫苗诱导的体液免疫、黏膜免疫以及肺部T细胞免疫。
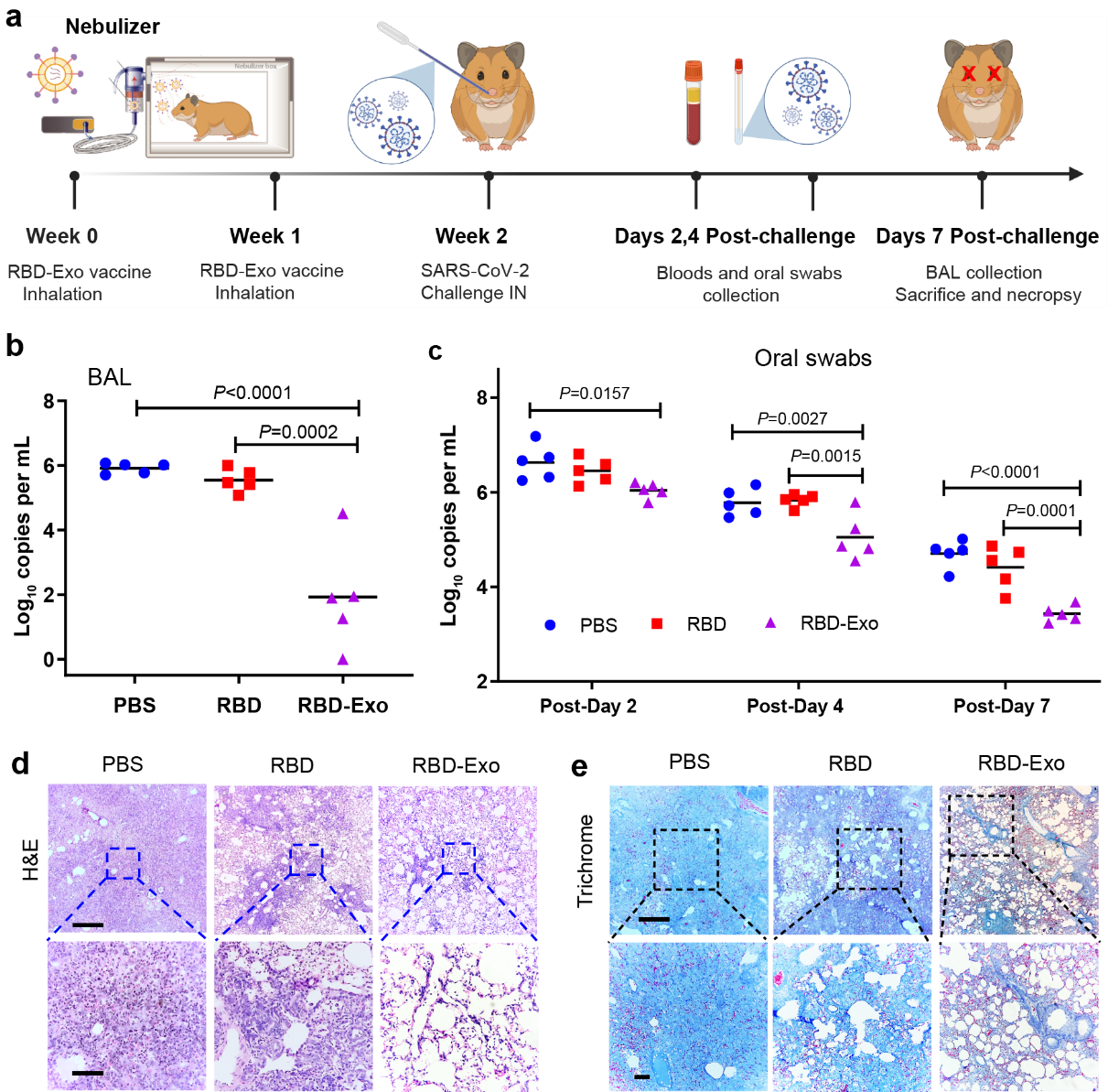
成功验证疫苗诱导的多重免疫反应后,团队应用COVID-19仓鼠模型评估RBD-Exo疫苗预防新冠病毒的能力。仓鼠在第0周和第1周雾化吸入接种RBD-Exo疫苗,共两次。对照组为吸入PBS或RBD抗原。在第2周(完全接种1周后),使仓鼠感染新冠病毒(图3a)。相比于PBS组以及RBD抗原对照组,吸入两剂RBD-Exo疫苗成功降低仓鼠的支气管肺泡灌洗液(BAL)以及口腔拭子(oral swabs)中的SARS-CoV-2病毒载量(图3b和3c)。仓鼠肺组织病理学(H&E和Trichrome染色)表明,接种RBD-Exo疫苗大幅度减轻了炎症细胞浸润以及肺纤维化,极大程度保留着肺泡组织的完整性(图3d和3e)。
图3:RBD-Exo疫苗在COVID-19仓鼠模型中的保护效果。(a)仓鼠模型测试RBD-Exo疫苗预防SARS-CoV-2感染的实验设计。(b)感染SARS-CoV-2七天后,仓鼠支气管肺泡灌洗液的病毒载量。(c)感染SARS-CoV-2后不同时间内仓鼠口腔拭子的病毒载量。(d & e)感染SARS-CoV-2七天后仓鼠肺组织的H&E(d)和Trichrome(e)染色。
综上所述,雾化吸入RBD-Exo疫苗具有良好的安全性和有效性,无需注射器、是一种非侵入性接种方式,可有效诱导系统体液免疫、呼吸道黏膜免疫和肺部T细胞的激活。不同于辉瑞和Moderna的mRNA疫苗、牛津-阿斯利康的腺病毒疫苗,其稳定性好、储存容易、无需专业人员注射,免疫原性强。北卡州立大学王真真博士,Kristen Popowski博士,和李振华研究员(现任职于南方医科大学附属东莞医院)是本文的共同第一作者。程柯教授与李振华研究员为本文的共同通讯作者。程柯教授是北卡大学教堂山分校-北卡州立大学Randall B. Terry, Jr. 再生医学杰出讲席教授、生物治疗实验室主任。国际医学与生物工程学院(IAMBE)会士、美国医学与生物工程学院(AIMBE) 会士、 美国心脏病协会(AHA) 会士。长期从事再生医学、干细胞工程学及转化医学的研究, 并积极推动干细胞和外泌体治疗的临床转化运用,领导了数个获得美国FDA批准的新药临床申请(IND)。参与创立多家生物技术公司,目前正在积极开发细胞以及细胞外囊泡在再生医学,癌症治疗和精准给药等领域的应用。自新冠肺炎爆发以来,团队运用在肺部疾病,纳米医药,外泌体等领域积累的技术基础,开发了一系列用于预防与治疗新冠病毒的潜在疫苗与细胞囊泡药物。去年,其团队研发的人源肺球干细胞衍生的纳米诱饵在食蟹猴新冠肺炎模型中显示出良好的治疗效果(Nat. Nanotechnol., 2021, 16, 942–951)(参考文献2);就在几天前,其团队系统性地证明了人源肺球体干细胞外泌体是吸入治疗呼吸系统疾病的理想载体,可向肺组织高效递送mRNA或蛋白,并荣幸成为Extracellular Vesicle (Elsevier)新刊的开篇之作(参考文献3)。这些技术将由程柯教授参与创立的Xsome Biotech生物技术公司(www.xsomebio.com)进行后续的开发和临床研究。参考文献:
1.Wang, Z. et al. Exosomes decorated with a recombinant SARS-CoV-2 receptor-binding domain as an inhalable COVID-19 vaccine. Nat. Biomed. Eng. 6, (2022), DOI:10.1038/s41551-022-00902-5
2.Li, Z. et al. Cell-mimicking nanodecoys neutralize SARS-CoV-2 and mitigate lung injury in a non-human primate model of COVID-19.Nat. Nanotechnol. 16, 942-951 (2021), DOI: 10.1038/s41565-021-00923-2
3. Popowski, K.D., et al., Inhalable exosomes outperform liposomes as mRNA and protein drug carriers to the lung. Extracellular Vesicle, 100002 (2022), DOI: 10.1016/j.vesic.2022.
外泌体资讯网 程柯团队最新Nature Biomedical Engineering:外泌体介导的雾化吸入式COVID-19疫苗