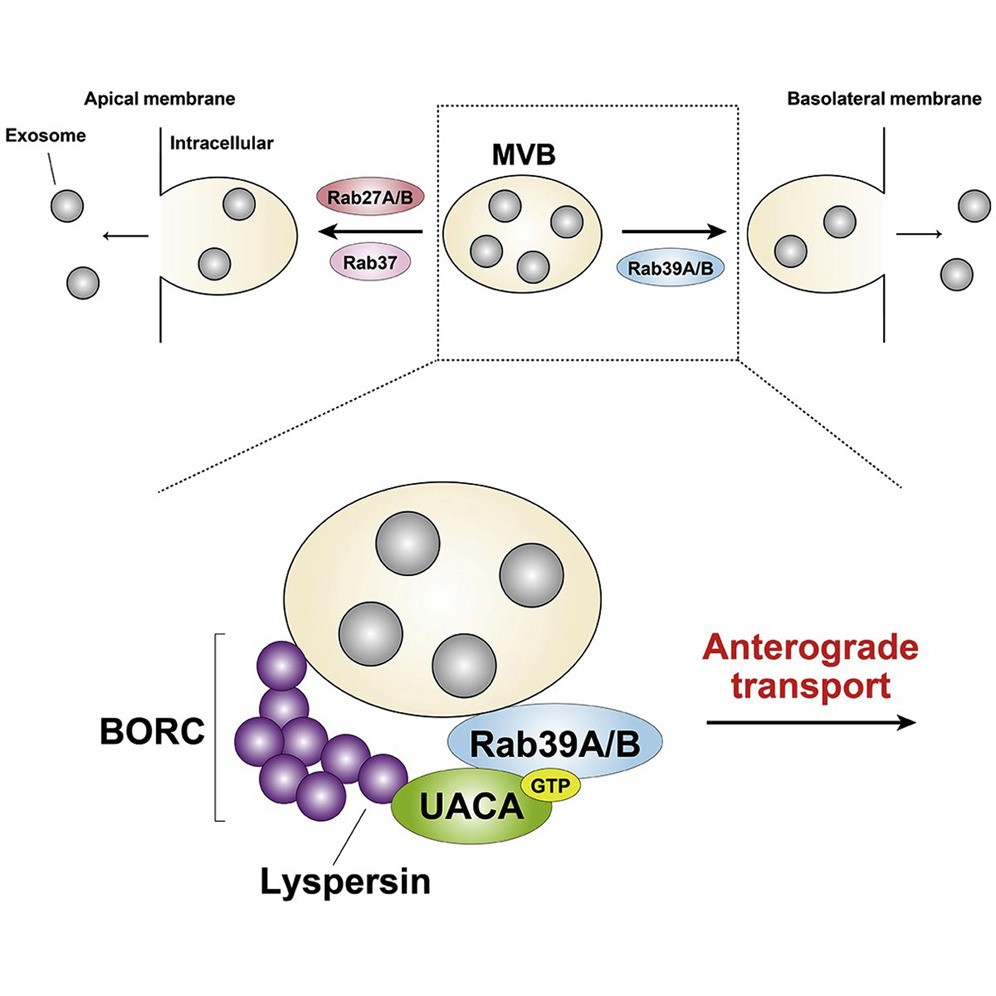
外泌体是源自多泡体 (MVB) 的小细胞外囊泡。极化的MDCK上皮细胞分泌两种类型的外泌体,顶端和基底外侧质膜外泌体,然而MVB如何选择性地靶向顶端或基底外侧膜此前未知。来自日本东北大学的研究人员分析了Rab家族小GTPase的成员,发现不同的Rab介导了不对称的外泌体释放。Rab27和Rab37参与顶端外泌体释放,而Rab39是基底外侧外泌体释放的特异性调节剂。在机制上,Rab39-UACA-BORC复合物特异性介导了基底外侧外泌体释放。该研究发表于Cell Reports杂志上。
外泌体是一种小细胞外囊泡 (sEV),直径为 50-150 nm,起源于晚期多泡体 (MVB)。最近证据表明,外泌体在介导特定蛋白质、核酸、糖缀合物或脂质在各种条件下向受体细胞递送的细胞间通讯中发挥着关键作用。并且,外泌体参与多种疾病的发病机制,包括癌症、神经退行性疾病和感染。
外泌体的释放是通过一系列组织良好的膜动力学过程实现的。首先,腔内囊泡 (ILV) 是外泌体的前体,由MVB的限制膜向内出芽到管腔侧形成。然后一些MVBs被转运到质膜,分泌性MVBs最终与质膜融合,导致ILVs以外泌体的形式分泌到细胞外空间。由于其余的MVB与溶酶体融合,其内容物在内吞途径中被降解,因此分泌的MVB必须通过某些机制有选择性地转运到质膜,而不是到溶酶体,才能有效地完成释放外泌体。
大多数细胞内转运途径由Rab家族小GTP酶控制。Rab通过在GTP结合的活性状态和GDP结合的非活性状态之间转换,来发挥分子开关的作用,而GTP结合的活性形式通过与特定效应蛋白的相互作用来调节膜流量。在哺乳动物中,已经鉴定出大约60种不同的Rab,并且认为每种Rab都表现出特定的细胞内定位并调节细胞内膜运输的不同步骤。其中一种哺乳动物Rab类型,Rab27(更具体地说是Rab27A和 Rab27B),已被确定为MVB转运至质膜的直接调节者。Rab27A、Rab27B 或两者同时在培养的哺乳动物细胞中被敲低 (KD) ,已被证明会减弱外泌体释放,因此Rab27的消耗通常被用作抑制外泌体释放的有效方法。然而,最近的一项研究表明,Rab27A/B-双敲除 (Rab27-DKO) 仅部分阻断了骨髓来源的树突状细胞的外泌体释放,表明Rab27不是Rab家族成员中驱动MVB转运至质膜的唯一执行者。
该研究团队曾报道了极化的上皮细胞系Madin-Darby犬肾 (MDCK) 细胞不对称地释放两种不同类型的外泌体,一种来自顶端质膜,另一种来自基底外侧质膜(分别称为顶端外泌体和基底外侧外泌体)。研究发现,这些外泌体具有不同的蛋白质组成,并且很可能是由不同的 MVB 通过不同的机制形成的。然而,尚不清楚不同的MVB如何选择性地靶向顶端或基底外侧膜。
在这项研究中,研究人员筛选了介导极化的MDCK细胞在不对称外泌体释放时的特定Rab,发现不同的Rab组参与了这一过程,即Rab27和Rab37介导了顶端外泌体释放,而Rab39(更具体地说是Rab39A和Rab39B),其参与外泌体释放此前未见报道,在本研究中被认为介导了基底外侧外泌体释放。研究人员还通过敲除细胞中的Rab39效应蛋白UACA及其相互作用蛋白Lyspersin(一种BLOC-1相关复合物(BORC)成分),来研究Rab39介导的基底外侧外泌体释放的分子机制。研究结果表明,Rab39-UACA与BORC形成复合物,这是一种调节MVB定位的多亚基复合物,并且这种复合物的形成是MVB顺行运输至基底外侧膜所特别需要的。
参考文献:Rab39 and its effector UACA regulate basolateral exosome release from polarized epithelial cells. Cell Rep. 2022 May 31;39(9):110875.