间充质干细胞(MSCs)在促进肝再生和修复肝损伤方面已成为生物医学研究的热点。MSCs是来自成体的组织干细胞,可以从胎盘、骨髓和脂肪等多种组织中分离出来,兼有免疫调节、多谱系分化、再生修复受损组织器官并重建其功能的作用,治疗疾病谱广泛,也是肝损伤修复细胞治疗的首选种子细胞。前期团队研究发现,移植的MSCs可到达受损肝脏,通过调节肝脏免疫系统缓解四氯化碳(CCl4)诱导的小鼠急性肝损伤。然而只有一小部分MSCs达到受损肝脏并短暂存活,因此我们推测除了MSCs本身外,MSCs释放的胞外囊泡(如外泌体,MSC-Exo)可能在治疗过程中也发挥重要作用。MSC-Exo包含特殊类型的RNA、脂质和蛋白质,具有维持细胞稳态、促进细胞增殖和组织再生的功能,可以应用于以MSCs为基础的无细胞治疗。近日,浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟/曹红翠教授团队在Cell Death & Disease 上发表了题为“Mesenchymal stem cells protect against ferroptosis via exosome-mediated stabilization of SLC7A11 in acute liver injury”的文章(2022 Mar 26;13(3),doi: 10.1038/s41419-022-04708-w),发现MSC-Exo通过维持SLC7A11的稳定性抑制肝细胞铁死亡进程,从而为铁死亡引起的ALI提供了一种新的治疗策略。浙江大学医学院附属第一医院曹红翠教授为论文通讯作者,博士生林飞燕为论文第一作者,李兰娟院士提供全面技术指导。
铁死亡(Ferroptosis)是一种铁依赖性的,区别于细胞坏死、细胞凋亡和细胞自噬等新型的细胞程序性死亡方式。其特征是在二价铁或酯氧合酶的作用下,大量脂质过氧化物的积累,从而诱导细胞死亡。它可导致多种疾病的发生,包括肿瘤如肝癌、神经退行性病变和组织损伤等。System XC-介导的抗氧化防御能有效地保护细胞和组织抵抗铁死亡。SLC7A11是一种多通道跨膜蛋白,在System XC-中介导胱氨酸/谷氨酸逆向转运活性。胱氨酸一旦进入细胞,就会迅速转化为半胱氨酸,而半胱氨酸是GSH的限速前体。有报道称,抑制SLC7A11可促进铁死亡,而上调SLC7A11表达可通过抑制铁死亡来促进细胞生长。该研究发现,在ALI小鼠模型中除肝脏坏死区域扩大外,肝脏内脂质过氧化水平也显著上调,提示脂质过氧化物过度积累。ALI小鼠肝脏和CCl4处理的人原代肝细胞的SLC7A11蛋白水平表达降低,与铁死亡相关的基因如前列腺素内过氧化物合酶2 (Ptgs2)和脂氧合酶(LOXs)表达增加。这些细胞和动物实验结果提示在CCl4诱导的急性肝损伤中,可能存在铁死亡。使用铁死亡抑制剂Ferrostatin-1和用MSCs、MSC-Exo干预均能下调小鼠肝脏脂质过氧化水平和铁死亡相关基因表达水平,同时恢复人原代肝细胞和小鼠肝脏中SLC7A11的蛋白水平。提示MSCs和MSC-Exo对ALI的保护作用部分是由于其抑制ALI铁死亡进程。进一步研究发现,MSC-Exo诱导的SLC7A11蛋白表达伴随着CD44和OTUB1的增加。CCl4引发的泛素化SLC7A11的异常表达可以通过OTUB1介导的去泛素化来拯救,从而增强SLC7A11的稳定性,激活System XC-,缓解CCl4诱导的肝细胞铁死亡。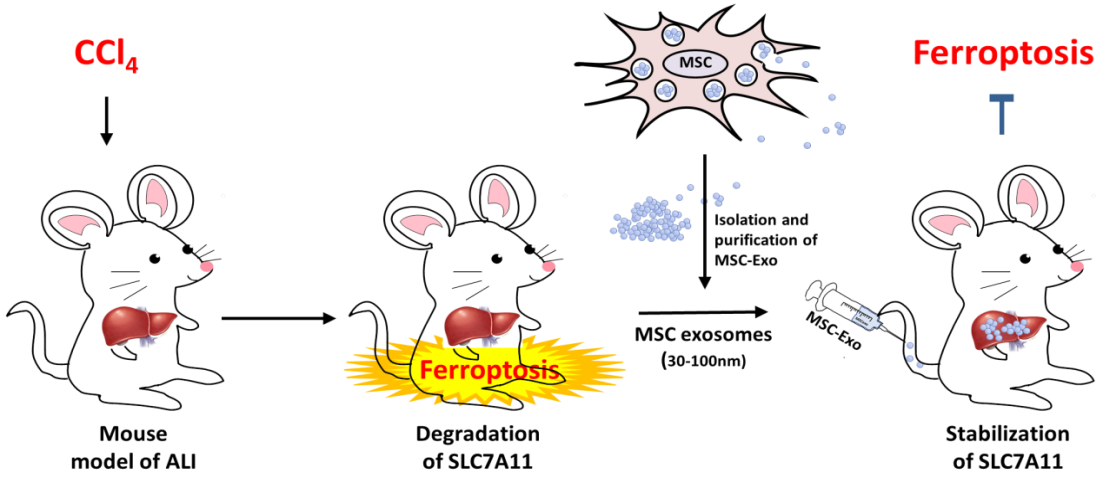
Mesenchymal stem cells protect against ferroptosis via exosome-mediated stabilization of SLC7A11 in acute liver injury. Cell Death Dis, 2022 Mar 26;13(3)外泌体资讯网 Cell Death Dis | 浙大医学院附一院李兰娟/曹红翠教授团队:间充质干细胞通过外泌体介导SLC7A11的稳定来抑制肝细胞铁死亡进程,而从缓解急性肝损伤