细胞外囊泡(EV)具有低免疫原性和良好的细胞转染能力,是一种具有良好应用前景的小干扰RNA(siRNA)递送载体。近年来研究发现,肿瘤来源的细胞外囊泡(TDEVs)作为肿瘤微环境中介导基因交换的关键载体,可利用其表面表达的蛋白输运货物至特定的受体细胞,可实现各种内源性物质(如RNA和蛋白质)的细胞间通信,在siRNA肿瘤递送方面潜力巨大。然而,TDEVs内容物中存在大量的致癌性成分,限制了TDEVs在药物递送中的应用。
近日,中国科学院上海药物所甘勇研究员团队在J Extracell Vesicles上发表了题为“Tumour-derived extracellular vesicle membrane hybrid lipidnanovesicles enhance siRNA delivery by tumour-homing and intracellular freeway transportation”的研究文章(2022, 11: 3; e12198), 该研究受生物膜伪装技术启发,选取肝癌(HCC)细胞来源的TDEVs并除去内容后得到TDEV膜。通过将TDEV膜和磷脂杂合制备了一种新型脂质纳米囊泡(LEV),实现了对肿瘤部位的精准递送和siRNA的高效转染。中国科学院上海药物研究所甘勇研究员、张馨欣研究员为本文通讯作者。中国科学院上海药物研究所周欣、缪云秋、王颖为本文共同第一作者。研究受到国家自然科学基金(81973250, 82025032)的资助。
采用去除TDEVs内容物的外泌体膜杂合磷脂制得的LEVs具有良好的生物安全性,可用于siRNA的稳定包载及递送,防止其在血浆中降解。LEVs可以通过硫酸肝素蛋白聚糖介导的途径促进其被来源HCC细胞特异性摄取,实现“归巢”靶向。入胞后,LEVs可以规避内涵体降解途径,通过高尔基体和内质网的胞内“高速路径”转运,显著提高了siRNA的转染效率。LEVs包载具有合成致死效应的siCDK1,增强了对HCC小鼠模型的抗肿瘤药效,显著延长了荷瘤小鼠的生存周期。该研究提出的TDEV膜衍生纳米囊泡作为一种新型siRNA递送策略在癌症治疗中的具有良好的应用前景。
图1 LEV的制备以及作用机制示意图
图2 siCDK@LEVs通过“归巢”靶向及胞内高速转运路径提高抗肿瘤药效
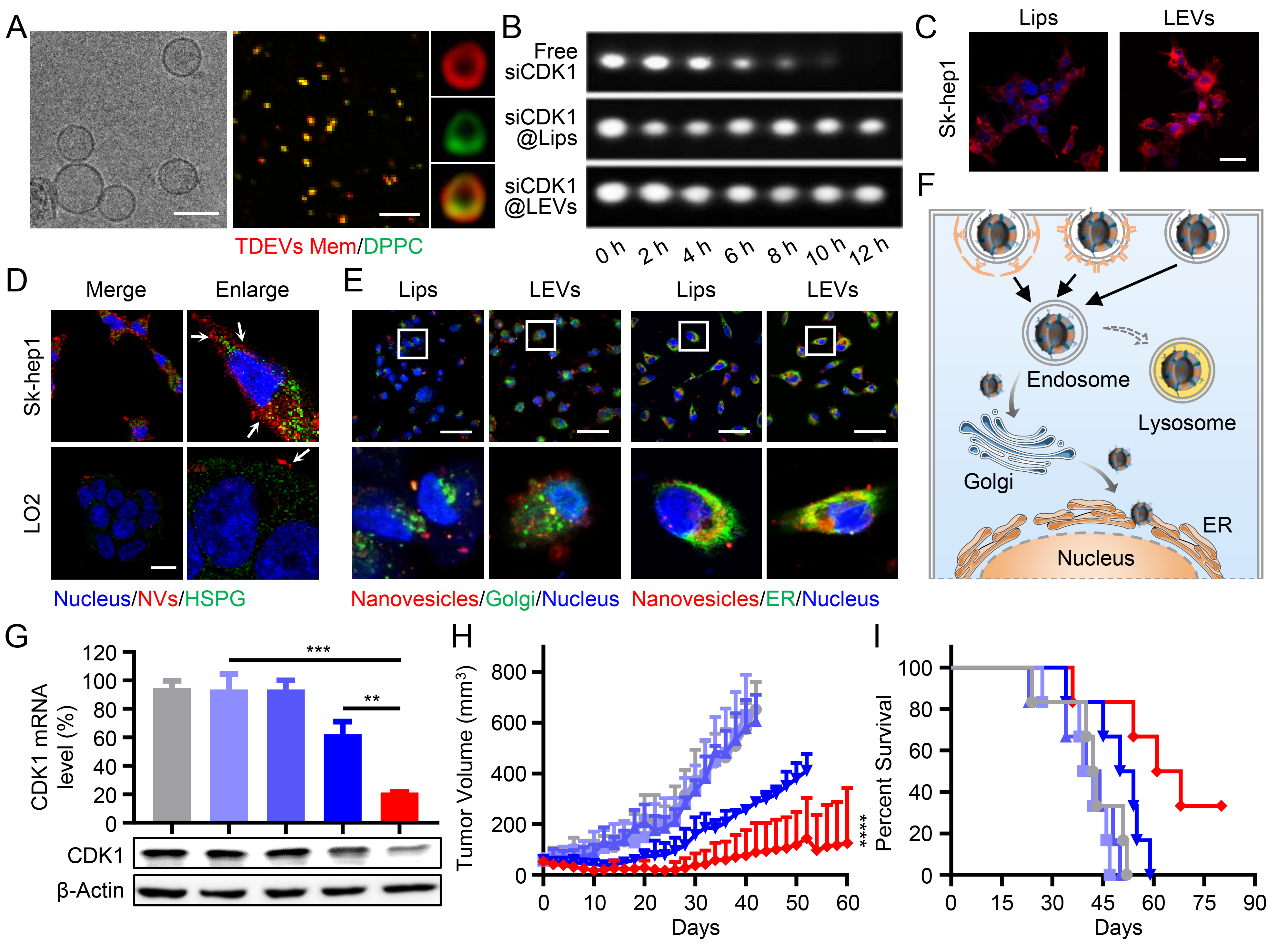
(A) LEVs的形貌及膜融合特征。(B) siCDK1@LEVs的血浆稳定性。(C, D) LEVs通过HBSP介导的入胞,提高Sk-hep1细胞摄取。(E, F) LEVs通过高尔基体-内质网途径实现胞内高速转运。(G-I) siCDK1@LEVs发挥高效抗肿瘤作用。
基因治疗能更精确地调节特定细胞中的基因表达,在多种疾病的治疗中显示出巨大的潜力。然而,由于不稳定性、脱靶效应等障碍的存在,siRNA、mRNA、microRNA等核酸药物的递送仍需克服各种挑战。针对这些问题,该文指出,利用TDEV仿生策略,采用源自不同细胞系的TDEV膜构建LEV载体,荷载各种治疗性siRNA药物,可实现对来源肿瘤细胞的归巢靶向递送。此外,考虑到核酸药物在结构、大小和电荷方面的相似性,该策略有望进一步应用于其它核酸药物的体内给药,实现更精准、更高效的基因治疗。
参考文献:
Tumour-derived extracellularvesicle membrane hybrid lipid nanovesicles enhance siRNA delivery bytumour-homing and intracellular freeway transportation. Journal ofextracellular vesicles. 2022, 11(3), e12198.
外泌体资讯网 JEV | 中国科学院上海药物研究所甘勇研究员团队:肿瘤细胞外囊泡衍生的脂质载体:一种siRNA递送的新策略