多细胞生物有效的抗病毒保护机制依赖于细胞自主免疫和全身系统性免疫。全身系统性免疫可以将抗病毒信号从感染组织传送至机体其它未感染组织,从而增强机体的抗病毒能力。哺乳动物中RNAi介导的抗病毒免疫机制在细胞自主免疫的研究层面上已经取得了许多重要进展,那么其是否采用系统性免疫反应来抵御病毒的侵染?该科学问题在世界范围内还没有任何相关的报道。2013年,来自中国科学院动物研究所李杨课题组的研究人员在Science上首次报道了哺乳动物中存在抗病毒RNA干扰(RNAi)的机制,受到了广泛的关注 1,2。但当时由于该领域的实验系统不完善,一些研究组在探索初期并未发现哺乳动物细胞感染病毒后会产生经典的病毒源siRNA—Dicer切割病毒复制中间体dsRNA的产物。在此之后,李杨课题组和一些研究组逐步建立了若干研究体系,陆续报道了包括Influenza A virus(IAV)1,Zika virus(ZIKV)2,3,Enterovirus A71 (EV-A71)4和Dengue virus-2 (DENV2)5在内的多种重要致病病毒可以在哺乳动物细胞中诱导抗病毒RNAi的发生,产生病毒源siRNA;相关研究也发现大多数病毒会编码一些抑制子蛋白来拮抗宿主的抗病毒RNAi通路。
2022年3月28日,李杨研究员与加州大学河滨分校丁守伟教授合作在The EMBO Journal上发表了题为“Mouse circulating extracellular vesicles contain virus-derivedsiRNAs active in antiviral immunity”的研究(2022 Mar28:e109902),揭示了哺乳动物中RNA干扰介导的抗病毒过程中存在系统性免疫的重要环节。
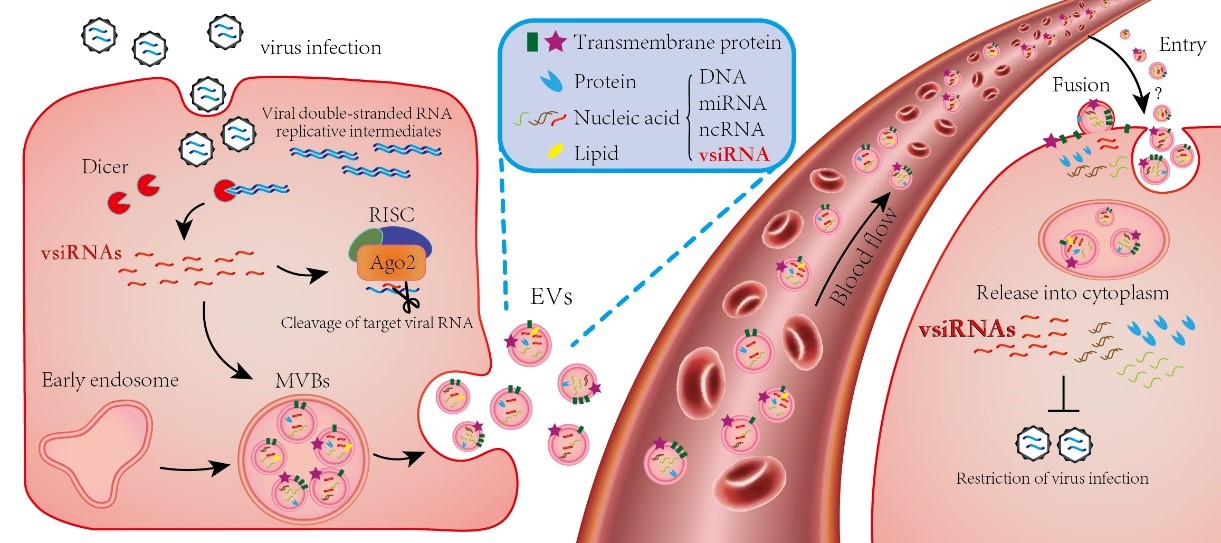
在该研究中,研究人员采用了抑制子缺陷的野田村病毒(NoVΔB2)感染小鼠,发现肌肉中产生的大量病毒源siRNA可以在小鼠体内稳定存在,甚至在病毒被基本清除后的两周还能检测到相当的丰度。同时,研究发现这种抑制子缺陷病毒的某些免疫特征类似于减毒的活疫苗,小鼠接种NoVΔB2可以对致死剂量的同源野生型NoV病毒感染起到完全保护的作用。病毒源siRNA如此稳定存在,这启发了研究人员从小鼠的血液中分离了胞外囊泡(主要为外泌体)进行了微小RNA测序。令人振奋的是,从感染NoVΔB2小鼠的外泌体中发现了大量的病毒源siRNA,并且它的特征和感染组织中分离的非常相似,而且它在血液中的外泌体上被大大富集了。同时,研究人员采用Sindbis virus(SINV)和ZIKV病毒感染小鼠,分离外泌体后进行微小RNA分析,同样检测到了大量经典的病毒源siRNA,外泌体中ZIKV源的siRNA甚至达到了miRNA总量的14.9%。接下来,通过小鼠的保护试验,证明了这种携带有病毒源siRNA的外泌体具有切割同源病毒RNA的能力,从而对小鼠起到免疫保护的效果,重要的是这种能力是依赖于RNAi通路的。有意思的是,近期南京大学吴稚伟团队在Molecular Therapy上发表了工程化细胞外小囊泡sEVsRVG通过递送抗病毒siRNA靶向胎鼠头部抑制ZIKV感染并减轻病毒造成的鼠小头症的研究论文6,这也从另外一个角度证明了携带有病毒源siRNA的胞外囊泡在自然的病毒感染过程可以起到抗病毒的作用。
综上,该研究首次揭示了哺乳动物中抗病毒RNAi如何采用系统性免疫反应来抵御病毒的侵染:这种系统性免疫由胞外囊泡(EV)介导,携带有病毒源siRNA的EV可以通过血液循环到未感染病毒的组织细胞,起到限制病毒侵染的功能。该研究阐明了哺乳动物中抗病毒RNAi的一个非常重要的环节,为全面了解哺乳动物中抗病毒RNAi的作用机制提供新的科学依据。
李杨课题组博士后张玉嫱和博士生戴云鹏为该论文的共同第一作者,李杨研究员和丁守伟教授为论文的共同通讯作者。中科院巴斯德所钟劲研究员和徐咏芬研究员为该研究提供了支持。
原文链接:http://doi.org/10.15252/embj.2021109902
参考文献:
1、Li, Y. et al. Induction and suppression of antiviral RNA interference byinfluenza A virus in mammalian cells. Naturemicrobiology 2, 1-9 (2017).
2、Zhang, Y. et al. The activation of antiviral RNA interference not onlyexists in neural progenitor cells but also in somatic cells in mammals. Emerging microbes & infections 9, 1580-1589 (2020).
3、Xu, Y. P. et al. Zika virus infection induces RNAi-mediated antiviralimmunity in human neural progenitors and brain organoids. Cell Res 29, 265-273,doi:10.1038/s41422-019-0152-9 (2019).
4、Qiu, Y. et al. Human Virus-Derived Small RNAs Can Confer AntiviralImmunity in Mammals. Immunity 46, 992-+,doi:10.1016/j.immuni.2017.05.006 (2017).
5、Qiu, Y. et al. Flavivirus induces and antagonizes antiviral RNAinterference in both mammals and mosquitoes. Science advances 6,eaax7989 (2020).
6、Zhang, R. et al. sEVsRVG selectively delivers antiviral siRNA to fetusbrain, inhibits ZIKV infection and mitigates ZIKV-induced microcephaly in mousemodel. Molecular Therapy (2021).
外泌体资讯网 The EMBO Journal|中国科学院动物研究所李杨团队:哺乳动物中抗病毒RNA干扰的系统性免疫机制





