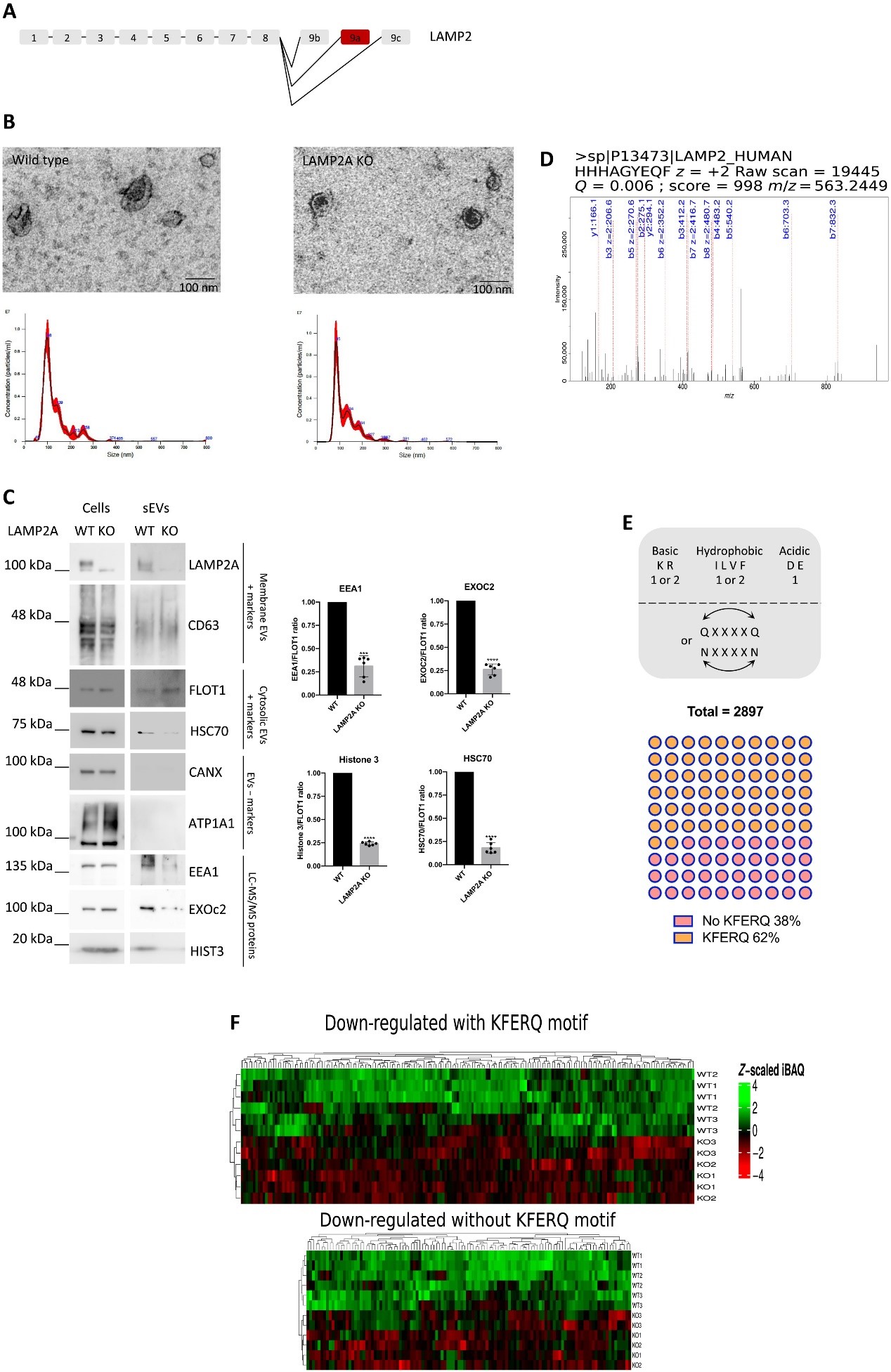
外泌体是内体来源的细胞外囊泡,可以在不同细胞、组织或器官之间转移脂质、RNA 和蛋白质。来自葡萄牙里斯本大学的研究人员发现,含有KFERQ五肽序列的蛋白质可以通过依赖于膜蛋白LAMP2A的过程中被包装到外泌体中,这是一种独立于ESCRT的新机制,也为外泌体工程开辟了新的应用途径。该研究发表于ScienceAdvances杂志上。 外泌体是直径为40至160 nm的纳米级囊泡,由大多数细胞类型分泌到细胞外空间。含有脂质、代谢物、蛋白质和RNA的外泌体可以在免疫功能、病毒感染、代谢调节、肿瘤转移和神经退行性变等多种生物过程中将细胞信息从一个细胞转移到另一个细胞。此外,循环外泌体具有多种潜在用途,例如液体活检中的疾病生物标志物,并且人们正在努力建立工程化外泌体为疫苗和基因治疗等多种治疗方法或靶向蛋白质。外泌体由内体限制膜的向内出芽形成,产生含有腔内囊泡 (ILV) 的载有囊泡的内体,称为多泡体 (MVB)。这些MVB的一部分与质膜的融合,使ILV形成外泌体释放到细胞外空间。从起源细胞分泌后,外泌体可以与其他细胞对接和融合,或被其他细胞内化以递送其货物。ILV生物发生被认为主要由ESCRT(运输所需的内体分选复合物)机制介导。然而,研究发现ESCRT 缺失的细胞仍然可以产生 ILV。据报道,替代机制有助于ILV形成和货物分类,例如鞘脂神经酰胺、四跨膜蛋白CD63、Toll样受体运输伴侣 UNC93B1 或syndecan-syntenin-Alix 途径。值得注意的是,有充分的证据表明,外泌体的货物库不一定反映原始细胞的胞质内容物,表明其中存在主动的可溶性货物选择或分类机制。然而,控制可溶性细胞质成分选择和分选成外泌体的机制仍然很大程度上未知。 在这项研究中,研究人员发现含有与KFERQ基序相关的氨基酸序列的蛋白质被包装到外泌体的亚群中。研究人员确定以下几种蛋白是该机制的基本组成部分:溶酶体相关膜蛋白2的同工型A (LAMP2A),此前被认为是一种将含有KFERQ的底物靶向溶酶体的蛋白质;以及分子伴侣热休克蛋白HSC70。此外,研究人员证明蛋白质的包装发生在早期的内体膜上,并且依赖于内体蛋白CD63、Alix、Syntenin-1和RAB31,而不依赖于ESCRT机制蛋白的成分,例如如TSG101和VPS4b。进一步表明,这种机制在动物中具有生物学相关性。例如,研究人员发现缺氧主调节因子HIF1A通过其KFERQ 样基序的作用和内体中LAMP2A被包装到外泌体中,从而将HIF1A 转录活性从缺氧小包转移到体外常氧细胞和斑马鱼中的细胞。此外,研究结果揭示了一种开发工具来跟踪斑马鱼幼虫中外泌体从一种组织到另一种组织的转移,为研究外泌体介导的器官间通讯开辟了新的可能性。图:LAMP2A的敲除导致外泌体中含有KFERQ序列的蛋白质下调。(A)LAMP2基因组序列的示意图。(B) TEM 图像显示分离的外泌体。(C) LAMP2A敲除导致 EEA1、EXOc2 和组蛋白3的蛋白质水平降低,其中每个都包含至少一个 KFERQ 基序,以及 HSC70。(D) HHHAGYEQF的原始 MS/MS 碎片谱,仅来自LAMP2A。 (E) 示意图显示了推定的 KFERQ 基序的识别规则。(F) LAMP2A KO 后 sEV 中下调蛋白的热图。总而言之,研究人员提出了LAMP2A在与ESCRT无关的过程中介导蛋白质包装到外泌体中,并且涉及HSC70对活性KFERQ序列的识别。CD63、Syntenin-1、Alix、Rab31和神经酰胺等内体蛋白似乎是这种选择性包装所必需的,尽管它们的作用尚不清楚。证据还表明,这种机制可能通过促进缺氧诱导因子HIF1A 包装到外泌体中来影响细胞间和器官间的通讯,从而有可能在远端的常氧细胞和组织中激活缺氧反应。 参考文献:LAMP2A regulates the loading of proteins into exosomes. Sci Adv.2022 Mar 25;8(12):eabm1140.外泌体资讯网 SciAdv丨LAMP2A介导了蛋白质向外泌体的分选和包装