帕金森病(Parkinson’s disease,PD)是人类第二大常见的神经退行性疾病,发病率仅次于阿尔兹海默病,其主要临床表现包括静止性震颤、运动迟缓、肌肉强直和姿势平衡障碍。主要病理特点包括黑质多巴胺能神经元丢失及神经元胞浆内存在大量蛋白聚集形成的路易氏体。α-synuclein (α-syn)是路易氏体的主要成分之一,它不仅存在于中枢神经系统(CNS)中,而且广泛存在于血液,特别是在红细胞中。此前,已有文章证明红细胞能够分泌含α-syn的细胞外囊泡(EVs),这些红细胞衍生的EVs (RBC- EVs)可以穿过血脑屏障(BBB),在星形胶质细胞和小胶质细胞中沉积α-syn,导致星形细胞功能障碍和小胶质细胞激活。除了运动和非运动功能障碍、多巴胺神经元缺失外,中枢神经系统炎症是PD发病的显著特征。有报道称在PD中小胶质细胞活化伴随炎症细胞因子增加和免疫细胞浸润。除了中枢炎症,PD患者也存在外周炎症。PD患者的外周炎症主要表现为循环系统内炎性因子异常升高,外周免疫细胞免疫超活化。同时PD患者外周循环系统内的单核细胞,在接受外来刺激时可生成并分泌的炎性因子,且PD单核细胞的免疫超活化程度与PD严重程度相关。尽管PD外周炎症已经被广泛证实,但目前有关PD患者外周炎症的研究仍处于探索阶段。考虑到外周炎症会促使PD病理进展,探索PD外周炎症的分子机制对PD的诊断、治疗具有非常重要的意义
2022年2月22日,浙江大学(医学院附属第一医院)章京教授团队在Journal ofNeuroinflammation上发表了题为“α-Synuclein-containing erythrocyticextracellular vesicles: essential contributors to hyperactivation of monocytesin Parkinson’s disease”的文章 (2022 Feb 22;19(1):53),阐述了外周RBC-EVs携带的病理性的寡聚的α-syn可导致循环系统里的单核细胞免疫超活化,这一过程需要受体介导的内吞作用和LRRK2激活。
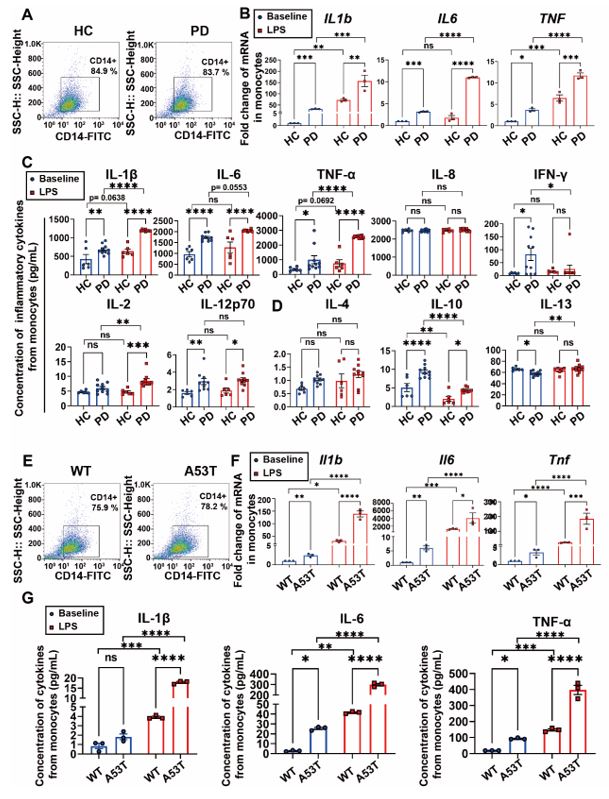
该研究首先检测PD患者外周单核细胞免疫超活化的程度。用LPS刺激外周单核细胞24小时,通过qPCR和超敏多因子电化学免疫发光检测平台(MSD)的炎性因子检测试剂盒检测发现,相较于健康对照,PD患者外周循环单核细胞在受到外来刺激时会产生更多的炎性因子,呈现免疫超活化状态。 作者之后引入外周过表达A53T突变型α-突触核蛋白的模型小鼠(后简称A53T小鼠),并评价了A53T小鼠外周单核细胞超活化情况,得到相同的结论(图1)。
图1. PD患者与A53T小鼠外周单核细胞免疫超活化
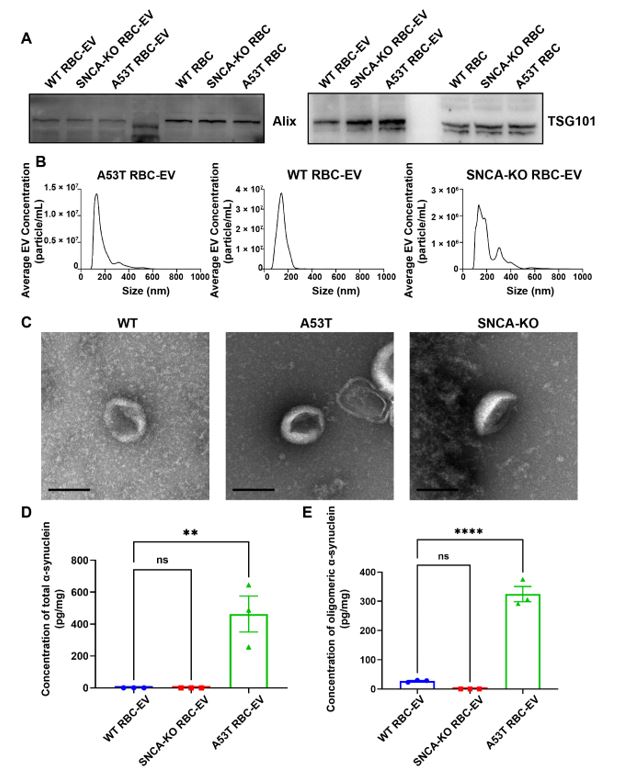
作者采用Western blot、NTA、透射电子显微镜(TEM)对RBC-EVs进行表征。结果表明,在WT小鼠、PD模型小鼠以及SNCA-KO小鼠之间RBC-EVs的粒径分布无显著区别;相较于WT小鼠与SNCA-KO小鼠来源的RBC-EVs,PD小鼠来源的RBC-EVs携带有更多不同形式的α-突触核蛋白(图2)。
图2. 小鼠来源RBC-EVs表征
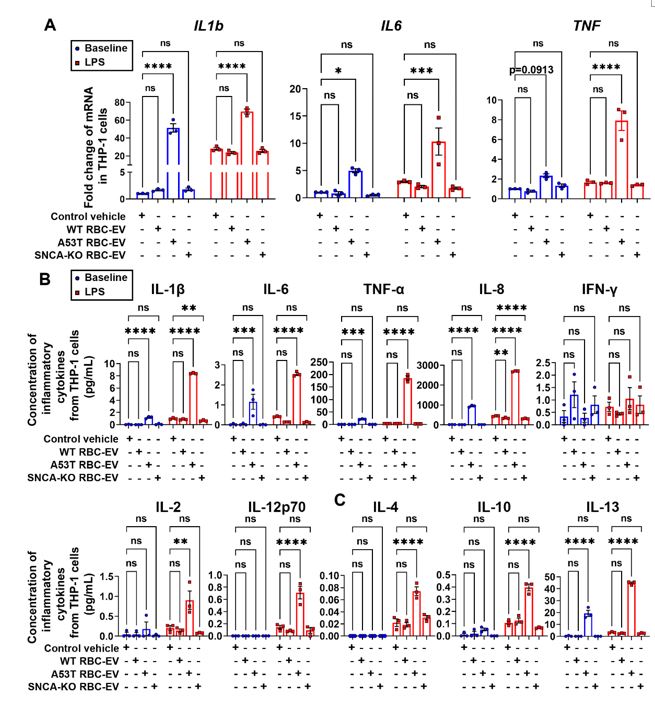
为了探索携带α-突触核蛋白的RBC-EVs在免疫超活化中的作用,作者选择THP-1细胞系作为单核细胞模型,用不同来源的RBC-EVs预处理THP-1细胞24小时,随后加入LPS刺激THP-1细胞产生免疫反应,通过qPCR以及MSD检测THP-1细胞炎性因子生成情况。结果表明相比于WT小鼠,A53T小鼠的RBCEVs能够对THP-1单核细胞产生显著免疫超活化作用(图3)。
图3. 携带α-突触核蛋白的A53T小鼠来源RBC-EVs引起THP-1细胞免疫超活化
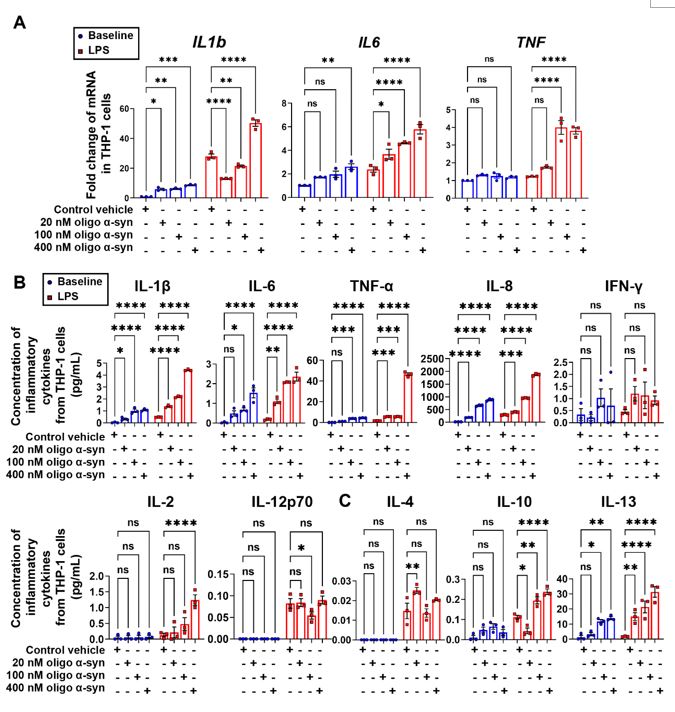
由于A53T小鼠是在外周过表达A53T突变型α-突触核蛋白所构建的动物模型,因此,作者推测α-突触核蛋白可能参与了A53T小鼠外周单核细胞免疫超活化过程。通过选择不同浓度寡聚体形式的α-突触核蛋白预处理THP-1细胞并检测其在接受LPS刺激后炎性因子生成的变化,结果发现寡聚体形式α-突触核蛋白处理后的THP-1呈现出显著免疫超活化状态,且随浓度增加,免疫超活化效果也逐渐增加,表现为炎性因子生成显著增加(图4)。
图4. 寡聚体α-突触核蛋白引起THP-1细胞免疫超活化
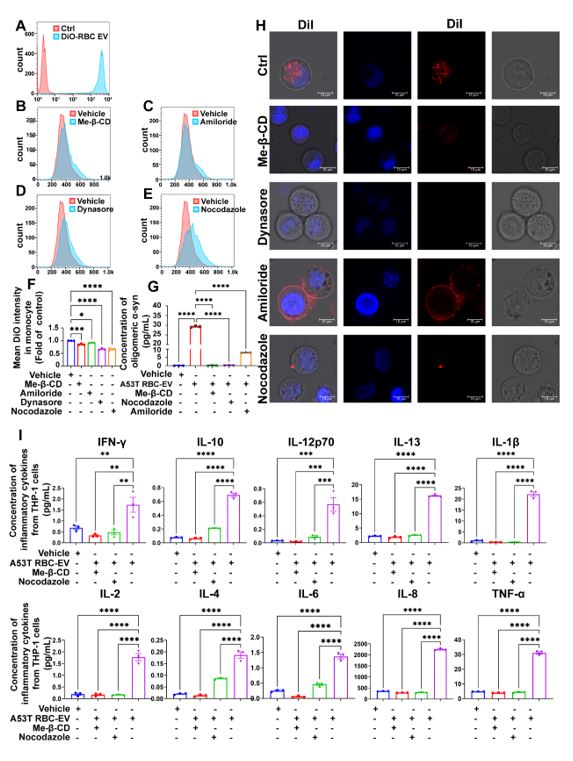
作者进一步探索RBC-EVs引起单核细胞免疫超活化的机制,采用四种不同类型的内吞抑制剂阻止RBC-EVs进入单核细胞并研究单核细胞的免疫超活化情况。结果发现其中两种抑制剂,Me-β-CD、Nocodazole可以显著降低由A53T RBC-EVs引起的免疫超活化情况。证明RBC-EVs对单核细胞的免疫超活化作用依赖于RBC-EVs进入单核细胞,通过抑制单核细胞对RBC-EVs的细胞内吞,可以缓解单核细胞的免疫超活化(图5)。
图5. 内吞作用参与A53T RBC-EVs诱导的单核细胞免疫超活化
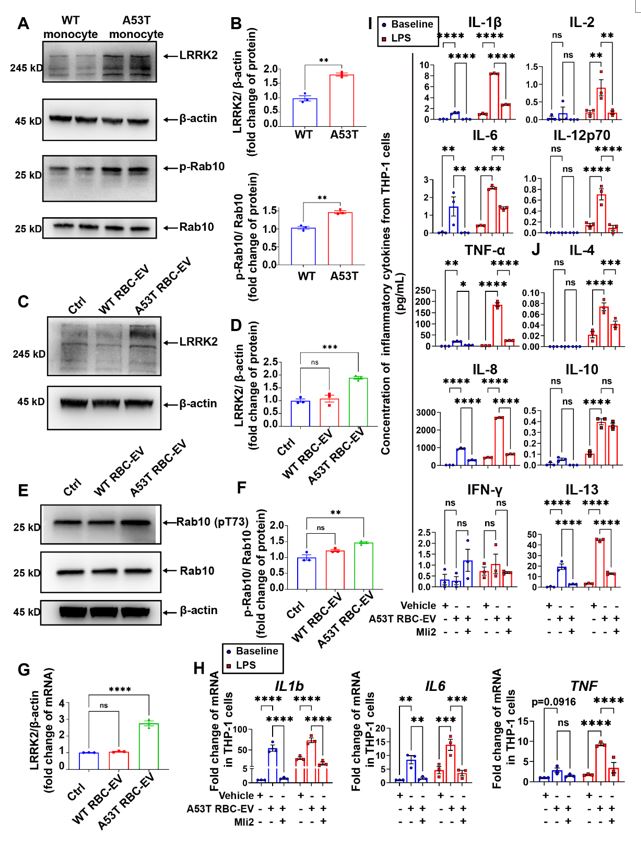
作者接下来研究RBC-EVs引起的单核细胞免疫超活化是否与LRRK2有关。结果发现,在A53T小鼠的RBC-EVs刺激下,THP-1细胞的LRRK2蛋白水平及其激酶活性增加,通过抑制LRRK2激酶活性,可以显著降低A53T RBC-EVs引起的THP-1细胞免疫超活化。由此,作者明确LRRK2参与了RBC-EVs引起的单核细胞免疫超活化(图6)。
图6 . A53T RBC-EVs引起单核细胞内LRRK2增加
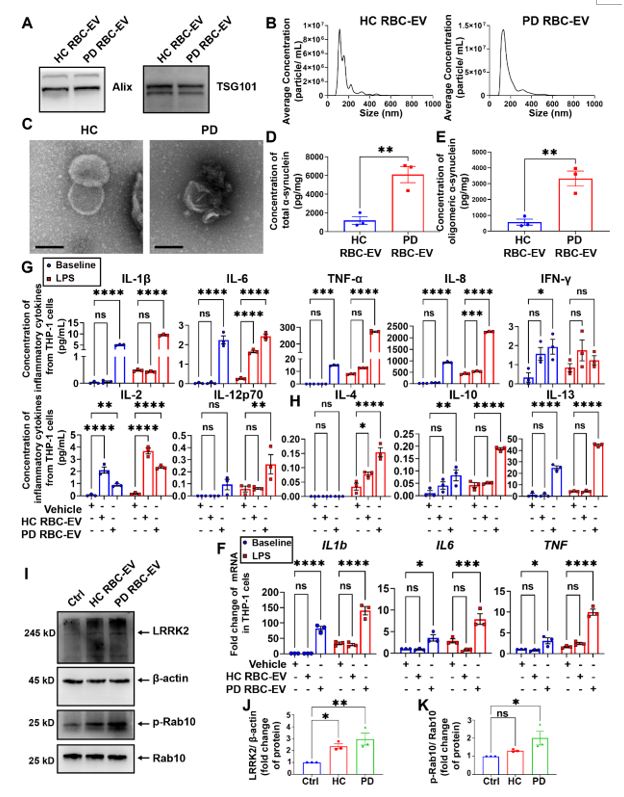
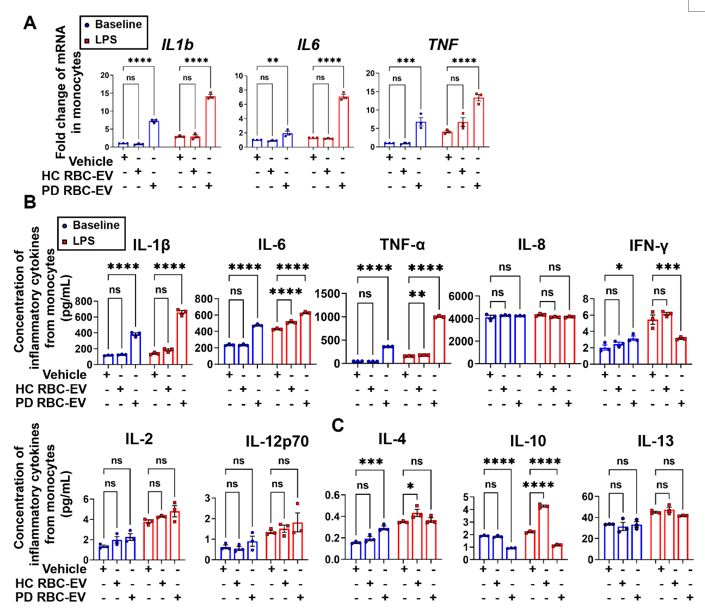
最后,作者采用PD患者以及健康对照的RBC-EVs对上述结果进行验证。进一步证明了携带有α-突触核蛋白的RBC-EVs通过激活LRRK2分子从而引起单核细胞免疫超活化的过程(图7,图8)。
图7. PD患者的 RBC-EVs引起THP-1细胞免疫超活化
图8 . PD患者RBC-EVs诱导单核细胞免疫超活化
综上所述,该团队的研究结果表明,外周RBC-EVs携带的病理性的寡聚的α-突触核蛋白可导致循环系统里的单核细胞免疫超活化,这一过程需要受体介导的内吞作用和LRRK2激活。此研究为散发性PD的免疫失调提供了一个新的视角,并强调了外周血单核细胞内的LRRK2抑制可作为改善PD发病机制的潜在治疗靶点。
参考文献:
α-Synuclein-containingerythrocytic extracellular vesicles: essential contributors to hyperactivationof monocytes in Parkinson's disease. J Neuroinflammation. 2022Feb 22;19(1):53. doi: 10.1186/s12974-022-02413-1.
外泌体资讯网 J Neuroinflam | 浙大附一 章京课题组:红细胞来源的细胞外囊泡携带α-突触核蛋白引起帕金森病单核细胞免疫超活化