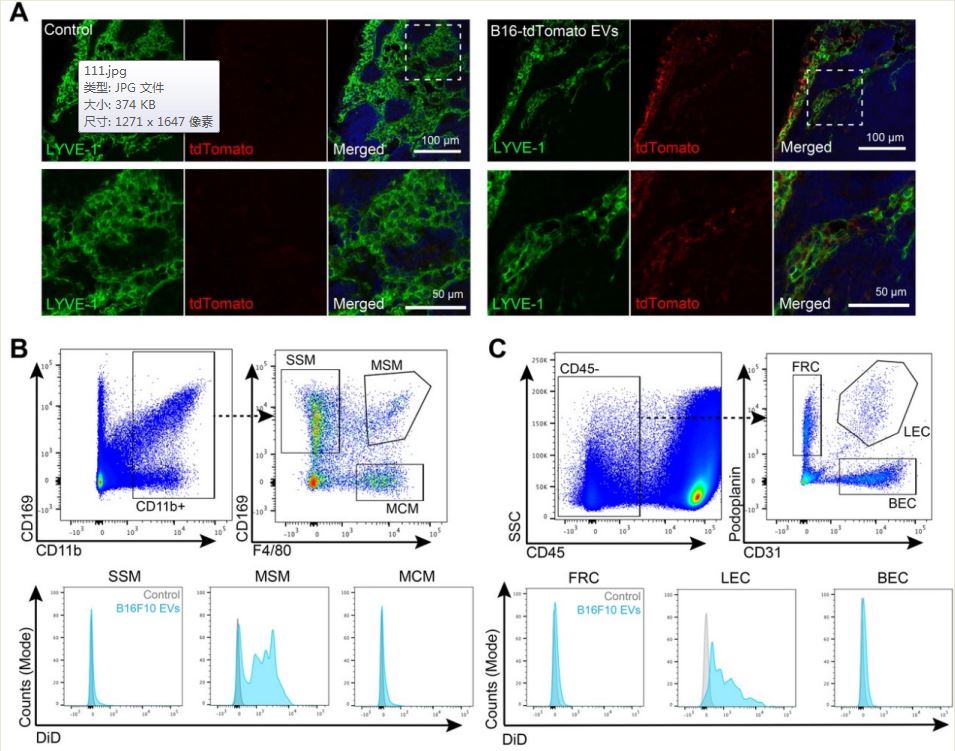
肿瘤引流淋巴结 (LN) 经历了大规模的重塑,包括淋巴窦的扩张,这一过程与肿瘤转移前生态位形成与淋巴转移有关。来自瑞士苏黎世联邦理工学院的研究人员发现,黑色素瘤衍生的细胞外囊泡(EV)与肿瘤引流LN中的一部分巨噬细胞和淋巴管内皮细胞(LEC)的高度选择性相互作用,有助于转移前生态位的形成和肿瘤免疫的抑制。该研究发表于JExtracell Vesicles杂志上。
肿瘤引流淋巴结(Tumour-draining LN)对肿瘤进展至关重要,通常作为第一个转移部位,在许多癌症类型中具有很高的预后价值。此外,它们在激活肿瘤特异性免疫和免疫治疗反应中具有关键作用。在原发性肿瘤生长过程中,引流的LN经常发生大规模重塑,由于白细胞流入而导致大小和细胞结构显着增加,而且包括LN驻留巨噬细胞和淋巴管内皮细胞(LEC)在内的细胞局部增殖,导致了淋巴窦扩张。此外,肿瘤引流LN中的 LEC 会发生表型变化。总之,肿瘤引流LN 的这些变化被认为有助于形成“转移前生态位”(PMN),从而促进肿瘤细胞随后的定植。然而,这个生态位的精确分子性质以及诱导肿瘤引流LN发生这些变化的信号仍然很大程度上未知。EVs,质膜包裹的亚细胞颗粒,已成为细胞间肿瘤-宿主通讯的重要组成部分。体内大多数细胞不断分离EV,但在癌症患者中EV的水平会升高。根据大小或来源等物理特性,EV 被分为不同的子类别,例如小的和大EV、“exosomes”(源自内体膜的囊泡)、“ectosomes”(源自质膜的囊泡)或凋亡小体。然而,EV子集的命名不一致,严格区分这些不同的EV类别在技术上非常具有挑战性。EV包含来自其供体细胞的各种生物分子,包括蛋白质、核酸或脂质,并且可以将这些分子信息长距离传递到体内的受体细胞或组织。因此,肿瘤细胞衍生的EVs以各种方式促进肿瘤进展,例如诱导肿瘤细胞迁移和侵袭、促进肿瘤血管生成和削弱肿瘤免疫。此外,释放到血液循环中的肿瘤衍生的 EV 被证明通过在肺或肝脏等远处器官中形成 PMN 来调节全身转移。在这些研究中,EV诱导的 PMN 形成依赖于骨髓来源细胞的培养、炎症的局部诱导和促进肿瘤细胞外渗的血管通透性。有趣的是,PMN的位置形成取决于肿瘤衍生EV中的特定粘附分子作为“归巢”受体将EV引导至其靶器官。虽然如上所述的大量研究已经研究了EV在血液循环中的肿瘤促进功能,但令人惊讶的是,EV与淋巴系统的相互作用知之甚少。可以想象,脱落到周围间质空间的肿瘤细胞衍生的 EV 主要通过与肿瘤相关的淋巴管排出,并被转运到肿瘤引流LN,但EV在这些LN中的命运和功能在很大程度上是未知的。事实上,肿瘤细胞释放的大部分EV确实被淋巴管吸收,并被运输到(并可能保留在)引流LN。在功能上,将黑色素瘤衍生的EV注射到足垫中可促进随后注射的肿瘤细胞在腘窝LN的定植,这可能是由于通过诱导炎症反应在LN内形成 PMN。其他研究发现,肿瘤细胞衍生的EV被LN巨噬细胞吸收,特别是位于淋巴窦内的CD169+ 巨噬细胞。与CD169+巨噬细胞类似,鼻窦内壁的 LEC 也与淋巴直接接触,并已被证明可以吸收和处理淋巴传播的抗原。然而,关于LEC 吸收肿瘤衍生 EV 的能力目前仍有争议。在这项研究里,研究人员发现源自黑色素瘤细胞的EV可通过淋巴管快速转运至引流LN,在那里EV选择性地与LEC以及髓窦巨噬细胞相互作用。有趣的是,LN驻留的LEC对黑色素瘤EV的摄取依赖于淋巴VCAM-1的表达,并诱导这些细胞的转录变化和增殖。此外,黑色素瘤EV将肿瘤抗原转运至LN中的 LEC,并在MHC-I上交叉呈递,从而诱导抗原特异性CD8+ T细胞凋亡。这些数据将EV介导的黑色素瘤与LN中LEC 通讯确定为参与肿瘤进展和肿瘤免疫抑制的新途径,LEC中的EV摄取或效应机制可能是黑色素瘤治疗的新靶点。参考文献:Melanoma-derived extracellular vesicles mediate lymphaticremodelling and impair tumour immunity in draining lymph nodes. J ExtracellVesicles. 2022 Feb;11(2):e12197.外泌体资讯网 JEV丨黑色素瘤衍生的细胞外囊泡破坏引流淋巴结中的肿瘤免疫