Codiak BioSciences是一家临床阶段的生物制药公司,率先开发基于外泌体的疗法作为一类新的药物,近日宣布在Science Advances杂志上发表文章,报道了其候选产品exoASO-STAT6通过外泌体介导的肿瘤相关巨噬细胞基因重编程发挥显著的单药抗肿瘤功效。exoASO™-STAT6是一种新型的工程外泌体精准药物候选药物,正在开发用于治疗富含巨噬细胞的肿瘤。该研究论文详细介绍了临床前开发计划的结果,并强调了exoASO-STAT6选择性靶向肿瘤相关免疫抑制巨噬细胞(TAM)并精确破坏STAT6信号传导以在癌症模型中产生非常显著的单药抗肿瘤活性。免疫系统对肿瘤的发展和进展起着重要的保护作用,有效地消除了免疫原性癌细胞。使用检查点抑制剂(CPIs)进行癌症免疫治疗可以在转移性癌症患者中诱导持久的抗肿瘤反应;然而,约85%的患者未能从这些疗法中受益,至少部分是因为免疫逃避。肿瘤微环境(TME)中髓细胞的存在构成了对CPI治疗产生耐药性的主要机制之一。肿瘤相关巨噬细胞(TAM)是TME中的主要髓亚群,表现出促肿瘤、免疫抑制、“M2”样表型。大量临床数据表明TAM与预后不良密切相关。TAM通过多种机制阻碍抗肿瘤T细胞反应,包括抑制T细胞增殖、阻断CD8T细胞迁移至肿瘤、以及将其他免疫抑制细胞如调节性T细胞(Tregs)募集到TME中。靶向促肿瘤M2巨噬细胞以缓解免疫抑制和促进免疫介导的肿瘤消退是癌症治疗的关键。大多数针对巨噬细胞的治疗策略都集中在阻止未成熟髓细胞向TME募集或试图将TAM重编程为免疫刺激性M1样巨噬细胞。几种小分子药物和单克隆抗体,通过抑制趋化因子[例如,CCL2(CCMotif趋化因子配体2)]或生长因子[例如,集落刺激因子1(CSF1)/CSF1受体(CSF1R)]来靶向髓细胞的募集和扩增。在临床前模型或临床研究中未显示出实质性的单药活性,因此需要联合策略。类似地,通过TREM2(在髓样细胞上表达的触发受体2)抑制或磷脂酰肌醇3-激酶γ(PI3Kγ)的小分子抑制剂来调节TAM功能也依赖于与CPI的组合,才能在临床前模型中证明肿瘤生长消退。其他方法,如CD40激动剂和干扰素-γ(IFN-γ)等细胞因子可以诱导巨噬细胞重编程,但它们的治疗反应受到剂量限制毒性的限制。控制巨噬细胞M2极化的转录因子是TAM重编程的有吸引力的靶标,包括信号转导和转录激活因子6(STAT6)、STAT3和CCAAT/增强子结合蛋白β(C/EBPβ)。鉴于它们广泛的表达谱,靶细胞选择性是这些转录因子成药的关键方面。小干扰RNA(siRNA)和反义寡核苷酸(ASO)是用于药物转录网络的有前景的方法;然而,它们面临着诸如缺乏靶细胞选择性、细胞通透性低和脱靶相关的全身毒性等局限性,导致治疗窗口狭窄。靶向STAT3的ASO的临床开发受到剂量限制性毒性(如血小板减少)的限制。基于外泌体的递送系统有望靶向递送至特定细胞群以扩大治疗指数。外泌体是所有细胞释放的直径为30至200nm的细胞外囊泡。外泌体可以将功能性RNA和蛋白质转移到受体细胞并在局部和器官之间介导细胞间通讯的发现刺激了转化研究,重点是开发基于外泌体的疗法。外泌体可以被设计为向所需的靶细胞递送不同的治疗有效载荷,并且正在成为一种有效的递送系统。外泌体脂质双层的天然成分和包括前列腺素F2受体负调节因子(PTGFRN)在内的几种表面糖蛋白的表达已被证明可增强药物货物向包括TAM在内的髓细胞的递送。STAT6是包括癌症在内的各种病理条件下巨噬细胞M2转录程序的关键调节因子。在白细胞介素4(IL-4)或IL-13刺激下,磷酸化的STAT6二聚化并转移到细胞核,在那里它诱导M2特征基因如Arg1(精氨酸酶1)、Ccl17(TARC)和Mrc1(甘露糖受体C-Type1)的转录,并抑制M1或炎症基因(例如Nlrp3、Ccl5和Nos2)的激活。在TME中,CD4 T细胞、肿瘤细胞和其他细胞类型产生的高水平IL-4通过STAT6途径驱动TAM的免疫抑制表型。来自Stat6-/-荷瘤小鼠的TAM显示出M1表型,并表现出对各种肿瘤类型的排斥增强,这与STAT6在将TAM极化为M2表型中的作用一致。因此,TAM中的STAT6下调可能是重新编程TAM的有效方法。
该研究描述了一种独特的基于外泌体的方法,通过选择性地将靶向STAT6的ASO递送至TAM,将TAM重编程为促炎M1表型。这种新型工程外泌体exoASO-STAT6在静脉内给药后在肝脏中表现出最大的生物分布和STAT6沉默活性,而对其他组织的影响最小。exoASO-STAT6通过诱导TME重塑,在多个临床前肿瘤模型中作为单一疗法显示出强大的抗肿瘤活性。在结肠直肠癌和肝细胞癌(HCC)的同基因肿瘤模型中,exoASO-STAT6的瘤内或静脉内给药分别在大多数接受治疗的动物中导致显著的肿瘤生长抑制和完全肿瘤缓解(CR)。相比之下,在这些模型中,抗程序性细胞死亡蛋白1(PD-1)或抗CSF1R抗体作为单一疗法未能引发实质性的抗肿瘤反应。免疫表型研究显示,exoASO-STAT6处理的动物肿瘤中M2巨噬细胞显著减少,这与M1标志物的出现有关,并伴随着CD8 T细胞依赖性适应性免疫反应的激活。作者相信exoASO-STAT6是一种新型的一流疗法,可有效重编程TAM,并能显著增强抗肿瘤免疫反应。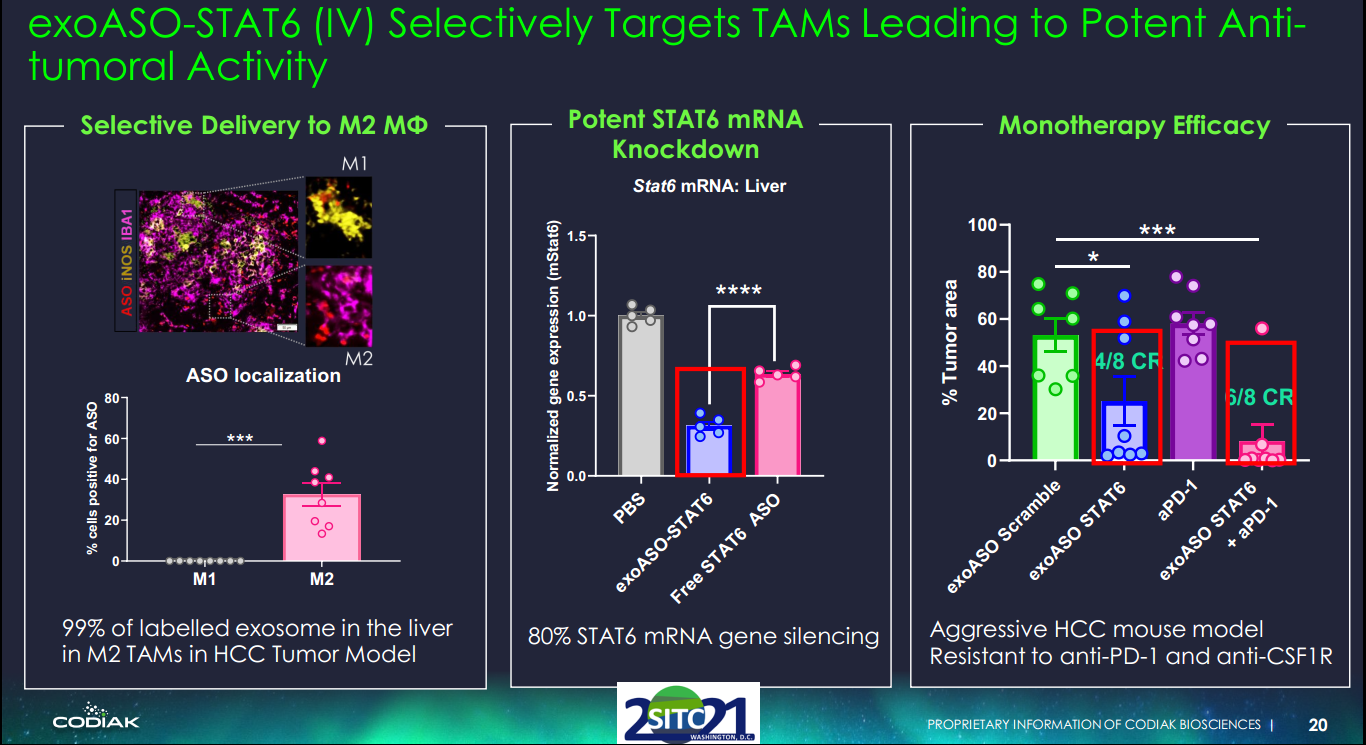
“根据我们的临床前观察,我们认为exoASO-STAT6是第一个显示出如此效果的单药抗肿瘤活性的巨噬细胞靶向候选药物,因此有可能克服先前针对转录因子的药物开发工作的重大障碍,” Codiak首席科学官Sriram Sathyanarayanan博士说,“该研究论文描述了exoASO-STAT6在几种临床前癌症模型中的独特属性和抗肿瘤活性,包括结直肠癌和肝细胞癌,我们打算将后者作为我们对该候选药物进行初步临床研究的重点。”TAMs通过表现出免疫抑制性M2表型来促进肿瘤生长。将TAM重编程为促炎M1表型是一种诱导抗肿瘤免疫的新方法。M2表型由关键转录因子(如STAT6)控制,已证明难以通过先前的方法在TAM中选择性地给药。Codiak已经证明,外泌体——天然存在的细胞外纳米颗粒囊泡——可以使用其专有的engEx™平台进行工程设计,以优先将STAT6靶向反义寡核苷酸递送至TAM。STAT6通路激活与包括肝细胞癌(HCC)在内的多种癌症的不良预后相关,具有高STAT6激活的患者可能会从exoASO-STAT6治疗中受益。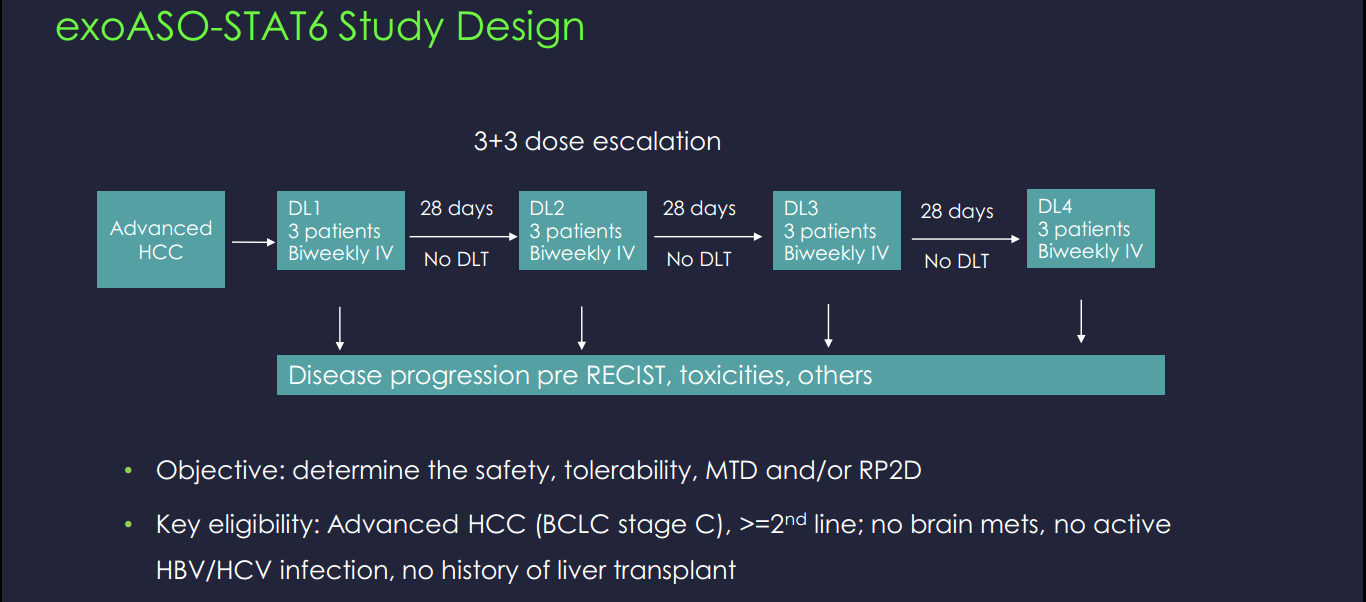
Codiak计划在2022年上半年启动1期临床试验,以评估exoASO-STAT6在HCC中的安全性、耐受性、生物标志物和初步抗肿瘤活性。通过这项试验,exoASO-STAT6将成为Codiak在临床开发中的第三个工程外泌体候选物。此外,exoASO-STAT6将成为该公司的第一个系统给药候选药物、第一个反义寡核苷酸有效载荷和第一个靶向转录因子的候选药物,突出了engEx平台的高度创新性。
exoASO-STAT6临床试验检测指标及结果预期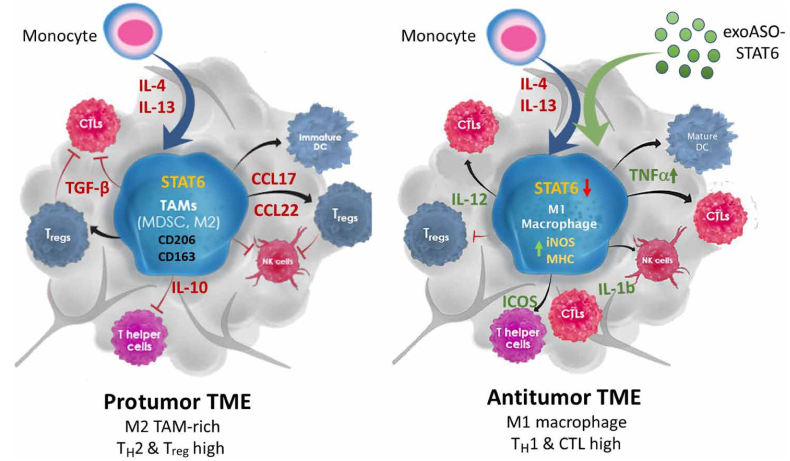
由exoASO-STAT6对TAM进行基因重编程介导的抗肿瘤活性的模式图通过促进Treg的募集和CD8细胞毒性T细胞的抑制,表达STAT6的TAM是免疫抑制性TME的关键决定因素。exoASO-STAT6选择性抑制免疫抑制性TAM中STAT6表达的能力导致有效重编程为M1表型,从而促进细胞毒性免疫反应和抗肿瘤TME的诱导。KamerkarS, Leng C, Burenkova O, Jang SC, McCoy C, Zhang K, Dooley K, Kasera S, Zi T,Sisó S, Dahlberg W, Sia CL, Patel S, Schmidt K, Economides K, Soos T, Burzyn D,Sathyanarayanan S. Exosome-mediated genetic reprogramming of tumor-associatedmacrophages by exoASO-STAT6 leads to potent monotherapy antitumor activity. SciAdv. 2022 Feb 18;8(7):eabj7002. doi: 10.1126/sciadv.abj7002. Epub 2022 Feb 18.PMID: 35179953.外泌体资讯网 Science Advances:Codiak公司发表首个系统性给药的外泌体药物临床前数据





