可编程导出RNA分子的系统将使细胞动态的非破坏性监测和工程化细胞的RNA高效递送成为可能。近日,来自加州理工学院的Michael B. Elowitz与Felix Horns团队在Cell杂志上发表文章,报道开发了基于病毒启发的遗传编码细胞RNA导出器,它们可以高效地从哺乳动物细胞中包装和分泌货物RNA分子,并将其保护在纳米颗粒中。导出和测序RNA条形码以克隆分辨率实现了对细胞群体动态的非破坏性监测。此外,通过将融合素纳入纳米颗粒中,证明了在接收细胞中被导出的mRNA的递送、表达和功能活性。这些系统称为COURIER(controlled output and uptake of RNA for interrogation, expression, and regulation)。COURIER使得细胞动态的测量成为可能,并为基于细胞间RNA递送的细胞和基因混合治疗奠定了基础。
RNA作为细胞中的中央信息载体,提供了一个强大的“接口”,用于读取和编写细胞行为。对RNA进行测序分析可以读取细胞状态。同时,RNA的表达控制着细胞状态。然而,RNA通常被限制在产生它的细胞内部,从而限制了它在分子分析和细胞间通信方面的实用性。相比之下,可编程地从细胞中导出RNA分子的能力可以解锁分析和控制活细胞的方法。
RNA输出/分泌(export)使细胞动态的非破坏性检测成为可能。单细胞RNA测序和杂交基因组学分析已经通过启用破译单个细胞的分子类型和状态的方法,彻底改变了生物医学领域。然而,通常需要裂解或固定细胞才能物理上访问RNA,这阻止了人们跟踪单个活细胞的动态行为。细胞外部游离的(cell-free)RNA自然地由细胞通过细胞外囊泡(EVs)或在死亡时分泌,对这类RNA进行测序可以非破坏性地揭示健康和疾病的生物标志物。然而,自然RNA分泌的低速率限制了cell-free RNA分析的灵敏度和信息含量。作为替代方法,工程化细胞以高效地导出编码有关细胞群体和状态信息的RNA分子,然后收集并对这些分泌的RNA进行测序,可以与自然cell-free RNA分析相比,实现对细胞动态的非破坏性测量,并具有更高的灵敏度和信息含量。
RNA输出/分泌(export)还可以解锁操纵细胞行为的方法。RNA编码蛋白质和调节基因表达的能力,可帮助对细胞行为进行可编程控制。然而,将这种能力用于治疗仍受到RNA传递到组织内特定细胞群体的挑战的限制。工程细胞输出RNA的能力提高了创建治疗性“递送细胞”的可能性,这些细胞归位于组织,识别目标细胞,并在接收细胞内执行不同功能的RNA的功能,包括改变它们的基因表达,重新编程细胞命运或选择性杀死处于疾病状态的细胞。这种策略可以规避使用其他传递载体时遇到的难题,在实现组织和靶向特异性方面,因为细胞能够穿透组织并利用基于细胞的感知和逻辑来有条件地调节局部RNA递送。这一愿景的基础组成部分是一个系统,它可以通过载体分泌RNA,并允许非工程受体细胞摄取和表达这些RNA。
病毒样颗粒(VLP)和外泌体(EVs)作为RNA分泌和递送的有吸引力的平台。病毒结构蛋白,它们形成的外壳以及它们与RNA包装信号(PSs)的自然相互作用已被用于在VLPs中包装和转移细胞之间的RNA。然而,这些方法通常依赖于逆转录病毒外壳蛋白,例如人类免疫缺陷病毒(HIV)或Moloney小鼠白血病病毒(MMLV)的外壳蛋白,这些蛋白仅对病毒RNA具有适度的结合特异性,并容易结合其他RNA,从而对特定载荷RNA的选择性装载提出挑战。VLPs和EVs已被改造以提高载荷RNA的选择性装载,包括将RNA结合蛋白融合到外壳或蛋白质中,这些蛋白质被纳入到EVs中,并使用同源相互作用序列标记载荷RNA。这些方法已被用于RNA递送,包括在小鼠体内,但需要进一步发展,因为它们受到低效的载荷装载和分泌、受限的载荷容量以及递送后载荷表达不良、影响VLP组装的外壳修饰等限制。
一个理想的RNA分泌系统将克服这些限制并提供几个关键特征。
首先,它将高效地从哺乳动物细胞中分泌RNA,从而允许敏感的测量和强效的递送。
其次,它将允许选择性地导出目标RNA,例如工程条形码或货物。
第三,它将保护导出的RNA免受细胞外RNase降解。
第四,它将使接收细胞中的货物RNA的递送和表达成为可能。
最后,导出系统组分的表达对表达细胞的干扰最小。
具有这些特征的RNA分泌导出系统可用于创建多功能基于RNA报告和递送平台。
该研究报告了具有这些特征的RNA分泌导出系统的开发,并应用这些系统来非破坏性地监测细胞群体动态和细胞间mRNA的传递。研究设计了一组RNA分泌导出器,将三种模块化蛋白组分组合在一起:(1)RNA结合蛋白以捕获特定的RNA分子,(2)自组装的外壳或囊泡以包装和分泌这些RNA,以及(3)融合素以将分泌的RNA传递到目标细胞。从VLP开始,经过几代RNA导出器的工程设计,最终得到了基于蛋白纳米笼子的细胞外囊泡,它们可以高效地从细胞中包装和分泌RNA,并在选择性方面对目标RNA进行了逐步改进。然后,将RNA导出与遗传条形码和测序相结合,以非破坏性地监测细胞群体动态。最后,通过将融合素纳入分泌的纳米颗粒中,证明了货物RNA在目标细胞中的递送和功能活性,包括编码Cre重组酶和荧光蛋白的mRNA。作者将这些系统称为COURIER,用于控制RNA输出和摄取以进行询问、表达和调节。这些结果将COURIER确立为一种灵活且可扩展的范例,用于非破坏性地测量细胞动态和RNA的细胞间转移。
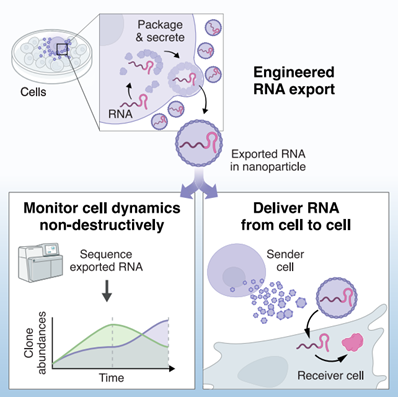
RNA导出器的开发,基于外壳和纳米笼子,用于RNA的包装和分泌、细胞的非破坏性监测以及mRNA的细胞间递送。
参考文献:
Horns F, Martinez JA, Fan C, Haque M, Linton JM, Tobin V, Santat L, Maggiolo AO, Bjorkman PJ, Lois C, Elowitz MB. Engineering RNA export for measurement and manipulation of living cells. Cell. 2023 Jul 10:S0092-8674(23)00689-X. doi: 10.1016/j.cell.2023.06.013. PMID: 37437570.





