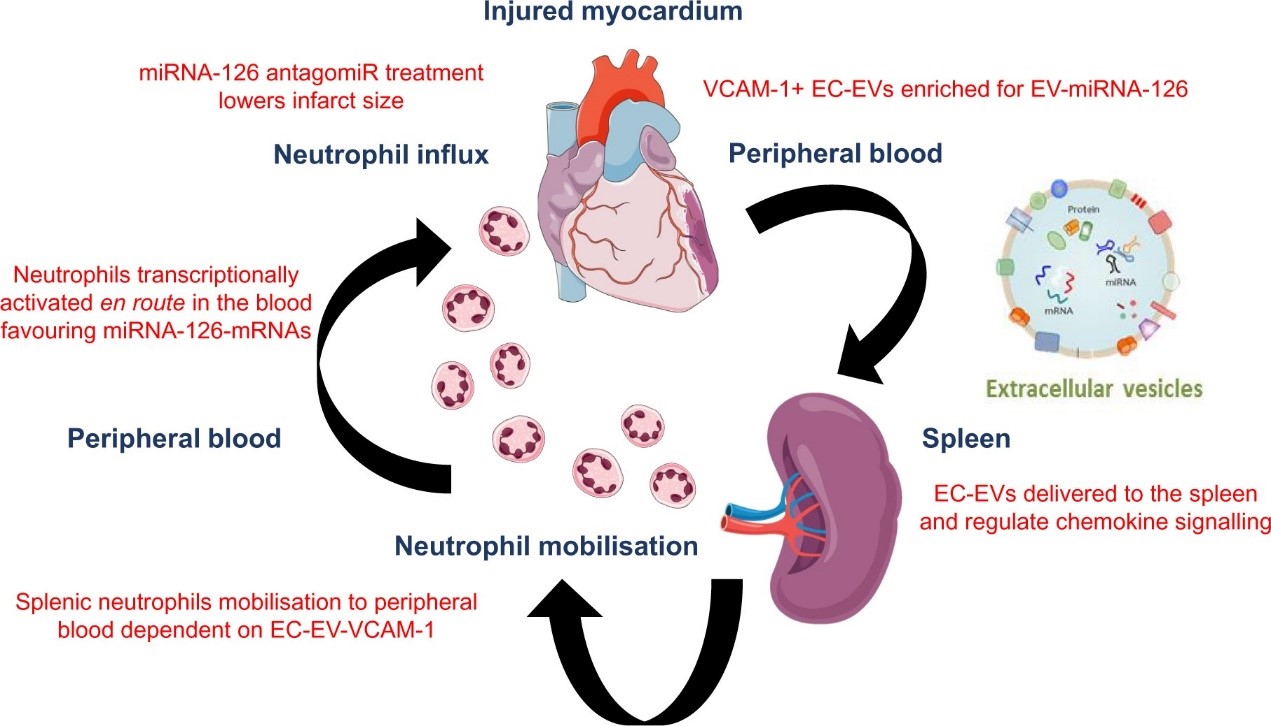
急性心肌梗死会迅速增加血液中性粒细胞(<2 小时)。中性粒细胞一般从骨髓释放,受趋化因子升高而响应,但趋化因子水平在心肌损伤后24小时以及中性粒细胞升高后才达到峰值。来自牛津大学的研究人员发现,梗死后内皮细胞(EC) 衍生的细胞外囊泡 (EC-EVs) 通过 EC-EV-VCAM-1介导脾脏的中性粒细胞动员,并诱导血液中中性粒细胞的激活,提出了一种新的非趋化因子依赖的过程。该研究发表于CardiovascularResearch杂志上。
急性心肌梗死 (AMI) 是一种器官实质性的无菌性损伤,可导致外周血中性粒细胞快速增加。 AMI后外周血中性粒细胞数量升高与心肌损伤程度、心功能不全程度和死亡率相关。中性粒细胞的耗竭增加了心脏破裂的易感性,并且在AMI之前中性粒细胞的抗体耗竭增加了梗塞面积,增强了纤维化,并降低了愈合心肌中M2巨噬细胞的数量。然而,在AMI中抑制中性粒细胞的募集可减少梗塞面积。这种相互矛盾的研究结果表明,中性粒细胞在心肌缺血性损伤和修复中发挥着复杂的作用。骨髓是粒细胞生成的主要部位,被认为是中性粒细胞的主要来源,这些中性粒细胞在损伤后被调动到外周血中。成熟的中性粒细胞大量保存在造血索中,其由血窦内皮与血液隔开。中性粒细胞通过CXCR4 和CXCL12的相互作用保留在骨髓中,并受一些可溶性因子而动员响应。在血管内注射一系列趋化因子,包括白三烯B4、C5a、白细胞介素8 (IL-8)、粒细胞集落刺激因子 (G-CSF),可以推动中性粒细胞在血窦内皮中的快速动员。然而,大量证据质疑这一点,源自受损组织的趋化因子可能不负责体内非常早期的中性粒细胞动员。在AMI再灌注治疗后,心肌细胞因子的mRNA水平在损伤后12小时达到峰值,并且促炎蛋白在冠状窦中非常温和地升高。此外,体内血液趋化因子谱在AMI后24小时达到峰值,并且不会先于人类或小鼠血液中性粒细胞计数的上升:在小鼠AMI后中性粒细胞数量上升发生2小时内,而大多数啮齿动物AMI是损伤后6-24小时观察到中性粒细胞升高。在中性粒细胞大量浸润前,目前尚未确定急性缺血心肌中这些趋化因子产生的来源。 这些观察结果表明,中性粒细胞可能在损伤后通过不依赖于趋化因子的机制从替代储备中调动。一种可能的来源是脾脏中的髓外造血系统,在细菌感染后中性粒细胞从那里动员到外周血中。例如,单核细胞在小鼠无菌性损伤后从脾脏储备中释放出来,这可以由源自血管内皮的细胞外囊泡 (EV) 驱动。EV是由许多细胞类型主动分泌的膜封闭的囊泡。这些囊泡带有生物活性货物,包括源自亲代细胞的蛋白质和microRNA (miRNA)。EV可以在释放到血液后局部和远程改变细胞的生物学功能和细胞状态。AMI 后,携带有血管细胞粘附分子-1 (VCAM-1) 的内皮细胞 (EC) 衍生的EV(EC-EV) 在血液中升高,并在AMI中脾单核细胞的动员和转录编程中起作用。 在这项研究里,研究人员试图确定EC-EV是否有助于中性粒细胞的早期动员和编程。他们发现,心肌损伤会迅速将中性粒细胞从脾脏调动到外周血,并在到达受伤组织之前诱导中性粒细胞的转录激活。血浆EV组成的时间过程分析显示,携带有VCAM-1的 EV 快速且有选择性地增加。这些EVs富含miRNA-126,优先在脾脏中积累,在那里EV诱导局部炎症基因和趋化因子蛋白表达,并将脾中性粒细胞调动到外周血。使用CRISPR/Cas9 基因编辑方法,研究人员制造了缺失VCAM-1的EC-EV,并表明VCAM-1的缺失消除了EC-EV 激发中性粒细胞动员的能力。此外,在小鼠模型中,体内抑制miRNA-126可减少心肌梗塞的大小。这项研究结果显示了一种新的EV依赖机制,EC-EV-miRNA货物可以在脾组织和细胞中诱导功能相关的转录程序,可将中性粒细胞从脾储备快速调动到外周血,然后再募集到受伤的心肌。这些机制将提示与AMI相关的细胞选择性免疫调节干预的可能性,EC-EV-VCAM-1 和 EC-EV-miRNA-126 是动员中性粒细胞脾储备的新机制。参考文献:Rapid neutrophil mobilisation by VCAM-1+ endothelial extracellularvesicles. Cardiovasc Res. 2022 Feb 4:cvac012.外泌体资讯网 Cardiovasc Res丨内皮细胞通过细胞外囊泡快速动员中性粒细胞的新机制