严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)引起了自2019年起的冠状病毒诱发疾病(COVID-19)大流行,疫情正持续危害人类健康。临床上针对SARS-CoV-2安全有效的治疗策略仍有待建立。这些病毒株通过血管紧张素转换酶2(ACE2)感染宿主细胞后,会造成爆发性的炎症反应(CRS)。近日,来自同济大学的李永勇、安毛毛、任天斌等合作在ACS Applied Materials & Interfaces杂志上发表研究论文”HACE2-Exosome-BasedNano-Bait for Concurrent SARS-CoV‐2 Trapping and Antioxidant Therapy “(https://doi.org/10.1021/acsami.1c19541),利用纳米诱饵策略重定向病毒攻击来控制SARS-CoV-2感染,并同时缓解炎症。李永勇、安毛毛、任天斌为本研究的共同通讯作者,博士生马骁一、郭诗雨为共同第一作者。该研究设计的纳米诱饵是一种基于外泌体包覆的聚多巴胺(PDA)纳米颗粒(PDA@Exosome),由H293T细胞吞噬PDA后胞吐并分离纯化得到。通过气管给药进入肺脏后,该纳米诱饵可以通过高表达的ACE2受体与上皮细胞竞争S蛋白的结合从而误导病毒攻击方向,控制新生病毒的继发侵染,避免炎症的持续放大。与此同时,利用纳米诱饵内负载的聚多巴胺进行抗炎,即通过抗氧化能力,控制已被激起的炎症。聚多巴胺与外泌体两者功能除能互补之外,在结构上,外泌体提供聚多巴胺必要的生物界面,有利于组织内扩散;聚多巴胺提高外泌体所需的粘附与稳定性。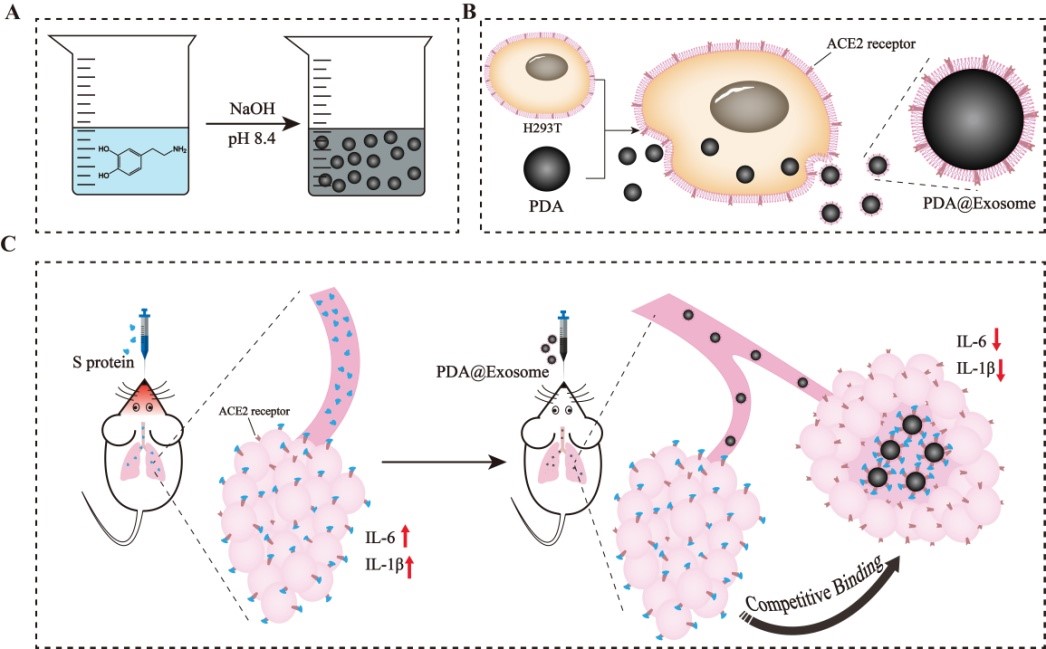
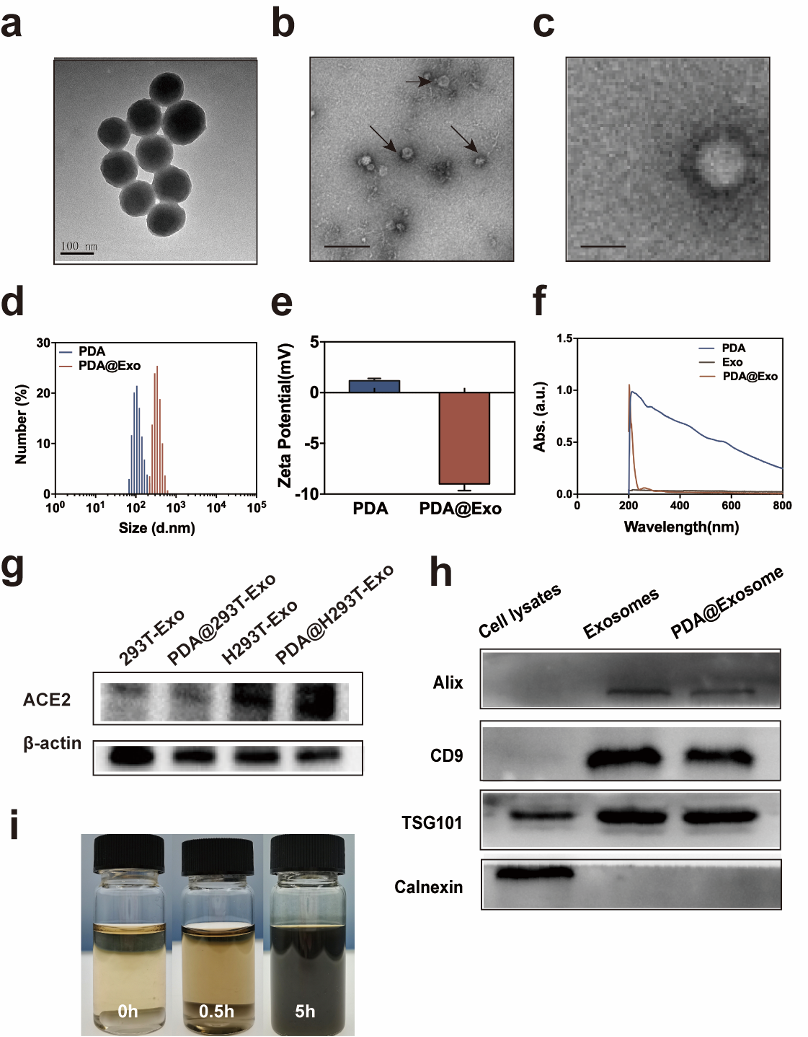
本研究结果证明了外泌体与聚多巴胺的协同作用,该纳米诱饵对S蛋白表现出良好的竞争结合效果。此外,与对照组相比,纳米诱饵组的小鼠炎症水平明显降低,肺部损伤较轻微,表明纳米诱饵能够有效缓解S蛋白引发的肺部炎症反应。由于外泌体和聚多巴胺均具有良好的生物相容性及便利性,这项工作中的纳米诱饵策略可能为 COVID-19 的治疗提供安全和经济的途径。此外,因为其功能更多地依赖于病毒表面S蛋白而非病毒结构本身,纳米诱饵策略也有利于应对致病性冠状病毒的不同变异株。HACE2-Exosome-BasedNano-Bait for Concurrent SARS-CoV-2 Trapping and Antioxidant Therapy. ACSAppl Mater Interfaces. 2022, 22. doi: 10.1021/acsami.1c19541.外泌体资讯网 ACSAppl Mater Interfaces同济大学:高表达ACE2的外泌体诱饵用于同时捕获SARS-CoV-2与抗氧化治疗

