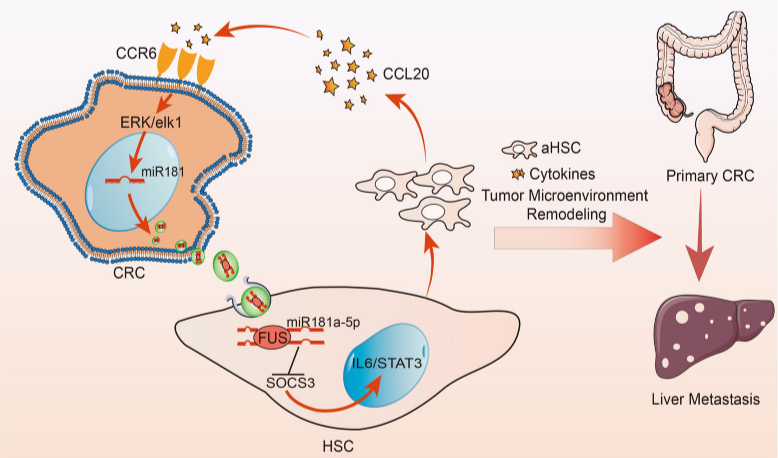
结直肠癌肝转移(CRLM)是结直肠癌(CRC)死亡的主要原因之一。肿瘤细胞与肿瘤微环境(TME)之间的相互作用在CRLM中发挥着重要作用。在 CRLM 期间,癌细胞可以通过重塑 TME 来诱导转移前小生境的形成。活化的肝星状细胞 (α-HSC) 特征被发现是继发性或原发性肝癌中最常见的生物学过程。α-HSC 可以从静止状态转分化为高度增殖和移动的肌成纤维细胞。此外,α-HSCs 可以通过重塑和沉积细胞外基质 (ECM) 来影响 CRC 细胞的生长和侵袭。因此,阐明肿瘤细胞与 TME 之间相互作用的机制对于理解 CRLM 的发生至关重要。
近日,复旦大学附属肿瘤医院大肠癌中心赵森林(第一作者)、李大卫及李心翔(共同通讯)在Journal of Extracellular Vesicles在线发表题为“Highly-metastaticcolorectal cancer cell released miR-181a-5p-rich extracellular vesicles promoteliver metastasis by activating hepatic stellate cells and remodelling thetumour microenvironment”的研究论文(2022,11(1):e12186),该研究发现高度转移性 CRC 细胞比表现出低转移潜能的细胞释放更多富含 miR-181a-5p 的细胞外囊泡(EV),进而促进 CRLM。此外,该研究验证了 FUS 介导 miR-181a-5p 包装成 CRC EV,通过靶向 SOCS3 和激活 IL6/STAT3 信号通路持续激活肝星状细胞 (HSC)。