恶病质是一种多因素,全身性综合征,多由癌症和其他严重慢性病引起。肿瘤恶病质患者极度消瘦,全身衰竭,生活不能自理,极度痛苦,约30%的癌症患者死亡的直接原因是肿瘤恶病质。肿瘤恶病质的主要机制包括肌肉萎缩、脂肪组织消耗、能量平衡失调及中枢神经系统稳态控制紊乱。在肿瘤负荷下,肿瘤细胞或肿瘤微环境分泌的炎症因子在肿瘤恶病质的发生发展中发挥的重要作用已得到广泛研究。最近有不少研究也表明,肿瘤组织来源的外泌体也参与了肿瘤恶病质的发展。
近日,华东师范大学化学与分子工程学院上海分子治疗与新药创制工程技术研究中心章雄文教授团队联合上海中医药大学交叉科学研究院刘璇教授团队发表的研究成果显示C26小鼠结肠癌细胞分泌的外泌体中的microRNAs可以通过诱导Bcl-2介导的骨骼肌细胞凋亡而诱发癌症恶病质,且STAT3在调控C26小鼠结肠癌细胞外泌体分泌中发挥重要作用并能够促进肿瘤的恶病质。研究结果以“Cancer-derivedexosome miRNAs induce skeletal muscle wasting by Bcl-2-mediated apoptosis incolon cancer cachexia”和“The critical role of STAT3 inbiogenesis of tumor-derived exosomes with potency of inducing cancer cachexia invitro and in vivo”为题分别发表在Mol. Ther. Nucleic Acids (2021;24:923–38)和Oncogene (2022 Jan 16. doi:10.1038/s41388-021-02151-3)上。阐明外泌体的分泌机制,寻找治疗肿瘤恶病质的可能靶点是非常重要和必要的。
STAT3是STAT蛋白家族成员之一,以促进肿瘤侵袭、血管生成、肿瘤细胞增殖、存活和免疫抑制的作用而闻名。已发现在大部分恶性肿瘤中IL-6/JAK/STAT3通路存在异常激活。STAT3在肿瘤恶病质的发展中发挥重要作用,STAT3抑制剂可改善肿瘤恶病质。STAT3在肿瘤恶病质中的作用使其成为新药开发的一个有吸引力的靶点。但是,在将STAT3抑制剂开发成治疗肿瘤恶病质的新药之前,必须更好地理解STAT3是如何发挥调节肿瘤恶病质的作用。STAT3对炎症因子如IL-6的调节作用已经得到广泛研究。然而,STAT3调控外泌体分泌的机制尚未完全阐明,并且STAT3调节外泌体分泌从而对肿瘤恶病质产生影响的作用还有待证实。
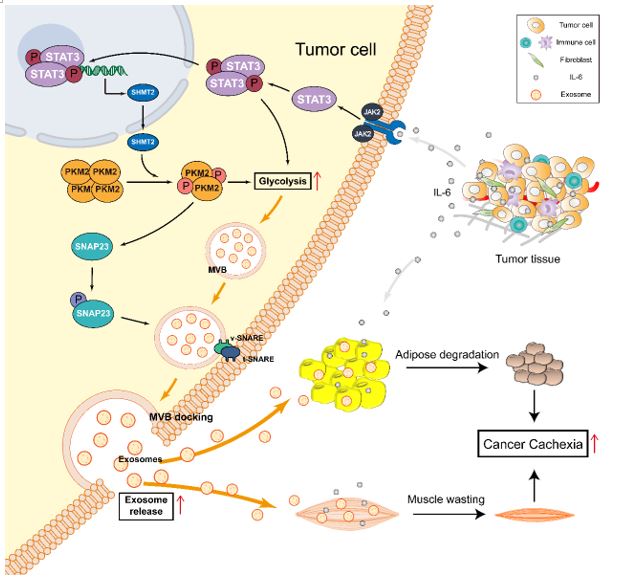
首先,该研究的结果不仅表明了STAT3在外泌体分泌中的作用,而且表明STAT3调控的外泌体分泌参与了肿瘤恶病质的诱导。该研究团队之前发表的文章(Mol.Ther. Nucleic Acids, 2021;24:923–38.)显示,C26和MC38同属于小鼠结肠癌细胞系,相较于诱导恶病质效应能力较弱MC38细胞,具有较强恶病质诱导能力的C26细胞明显具有更强的外泌体分泌能力,因此研究者对比了C26细胞和MC38细胞p-STAT3和STAT3的表达情况,发现C26细胞的p-STAT3和STAT3的表达水平显著高于MC38细胞。研究者构建了STAT3敲除(KO)及过表达(OE)的稳转C26细胞发现STAT3表达水平的改变影响了C26小鼠结肠癌细胞外泌体分泌的水平,从而影响C26细胞培养上清在体外诱导C2C12肌管萎缩和3T3-L1脂肪细胞脂解的能力,以及影响C26肿瘤组织诱导荷瘤小鼠恶病质症状的能力。
其次,该研究揭示了STAT3是通过对糖酵解和PKM2/SNAP23通路的调节参与了对C26小鼠结肠癌细胞外泌体分泌的调节。研究结果表明,C26-STAT3-KO细胞中的STAT3敲除显著降低了C26细胞的糖酵解水平,而C26-STAT3-OE细胞中STAT3过表达显着增加了 C26细胞的糖酵解水平。外泌体分泌能力较低的C26-STAT3-KO细胞的p-PKM2(糖酵解丙酮酸激酶的同工酶)和p-SNAP23(调控外泌体分泌的重要蛋白质)水平显著降低。具有较高外泌体分泌能力的C26-STAT3-OE细胞则具有更高的p-PKM2和p-SNAP23表达水平。
第三,该研究表明在人源肿瘤细胞中,STAT3/PKM2/SNAP23通路也参与了外泌体分泌的调控。进一步的对比多种人源癌细胞的外泌体分泌能力及STAT3/PKM2/SNAP23通路的表达情况,发现人源癌细胞外泌体分泌能力与STAT3、PKM2、SNAP23、p-STAT3、p-PKM2和p-SNAP23的表达水平呈正相关,并且作为广泛用于构建肿瘤恶病质小鼠模型的PANC-1细胞,它的外泌体分泌能力及STAT3/PKM2/SNAP23通路的表达水平是最高的。这些结果表明,STAT3/PKM2/SNAP23通路参与外泌体分泌调控具有普适性。
第四,STAT3抑制剂如 C188-9 和白术内酯 I (AI) 可通过抑制C26小鼠结肠癌细胞STAT3/PKM2/SNAP23通路的激活从而抑制外泌体的分泌,这表明C188-9和AI有可能用于肿瘤恶病质的治疗。
STAT3调控肿瘤细胞外泌体分泌的机制图
总的来说,该研究揭示了STAT3在调控肿瘤细胞外泌体分泌中的重要作用及其机制。STAT3抑制剂可以通过抑制肿瘤组织的外泌体分泌,从而改善肿瘤恶病质,这对于开发有效的治疗肿瘤恶病质的STAT3抑制剂有很大的帮助。
参考文献:
章雄文教授课题组:华东师范大学化学与分子工程学院上海分子治疗与新药创制工程技术研究中心章雄文课题组主要开展分子肿瘤药理学研究,针对抗肿瘤恶病质开展新药研发,建立并完善了肿瘤恶病质分子-细胞-动物循序互动的发现平台,研究发现数个安全高活性的全新化合物,及数个安全高活性的天然来源化合物数个,发表肿瘤恶病质相关的SCI研究论文9篇、综述1篇、申请专利6项。“天然产物鼠尾草酚的抗肿瘤恶病质药效及分子作用机制”和“肝脏和肠道微生物所致胆酸代谢失调参与肿瘤恶病质发生”研究工作发表在恶病质研究领域顶级刊物Journal of Cachexia,Sarcopenia and Muscle(医学一区,IF 12.91)上。
外泌体资讯网 Oncogene | 章雄文教授/刘璇教授团队:STAT3调控结肠癌细胞外泌体分泌及其对肿瘤恶病质的促进作用