肿瘤衍生的外泌体(TDE)在癌症生物学的多个方面发挥着关键作用。作为免疫监视系统的重要哨兵,自然杀伤(NK)细胞可以很早地识别恶性肿瘤细胞并抑制肿瘤的发展和转移。来自伊朗伊斯法罕医科大学的研究人员在Molecular Cancer杂志上发表综述,介绍了TDE在肿瘤诱导的NK细胞损伤中的作用和机制,并讨论了在肿瘤免疫治疗中消除TDEs对NK细胞影响的临床意义和潜在方法。
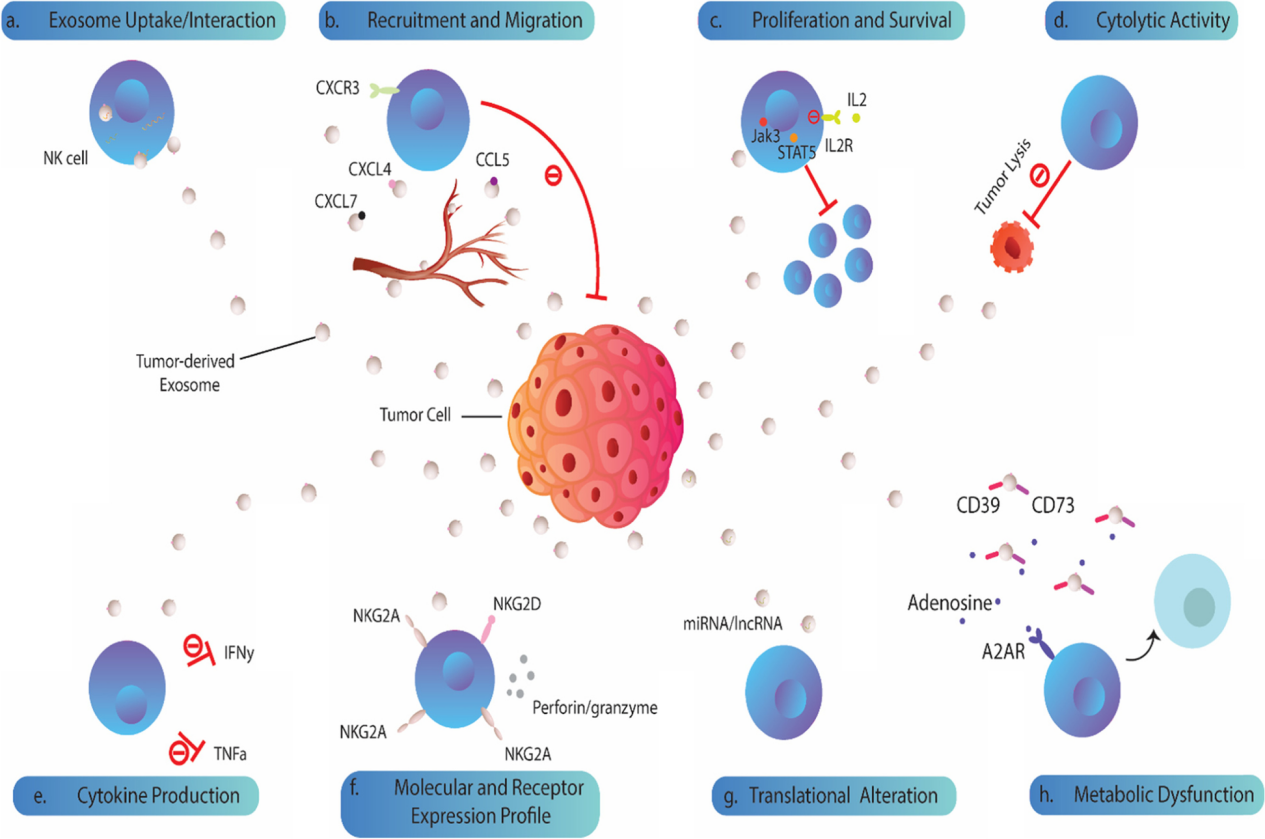
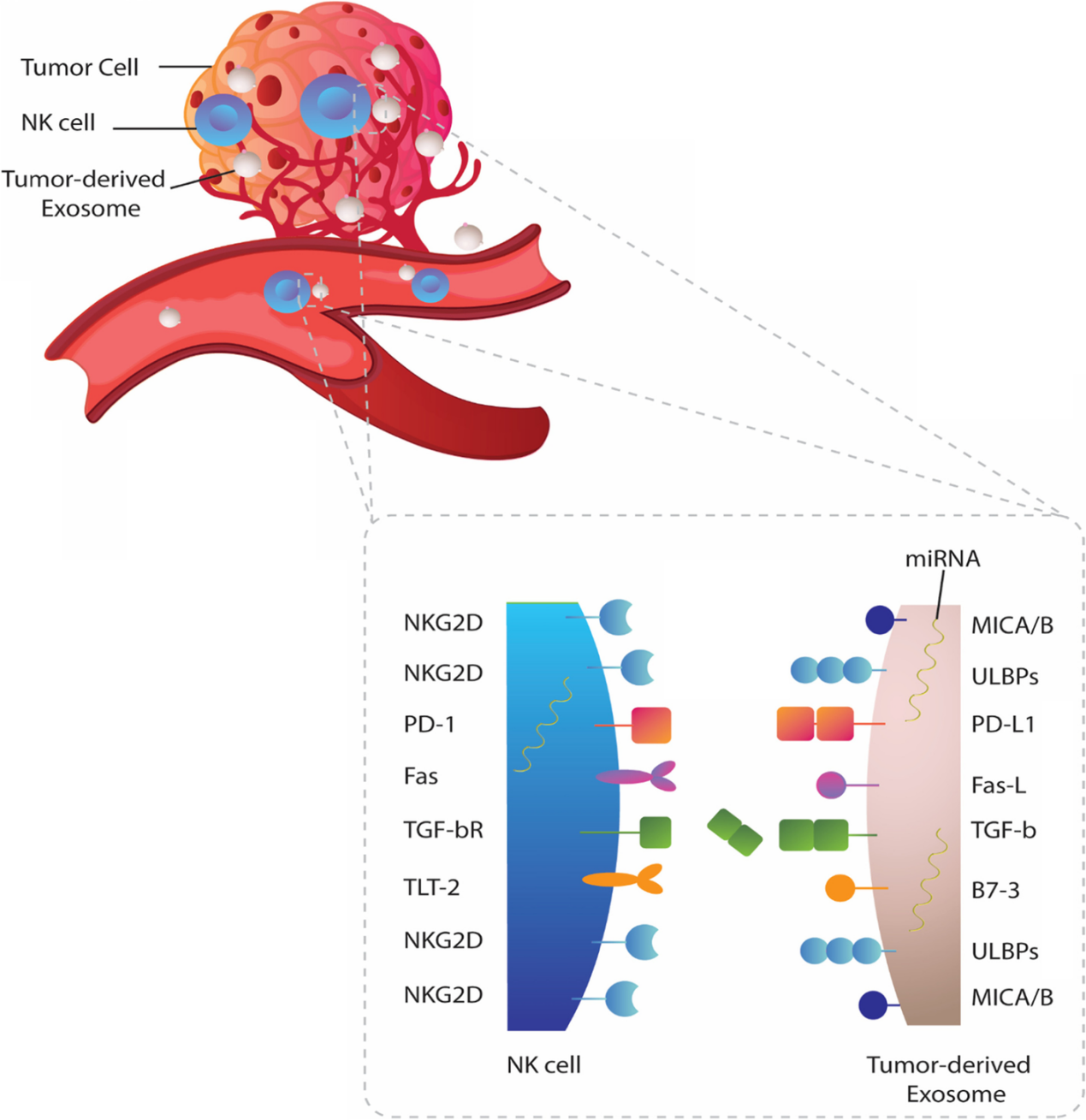
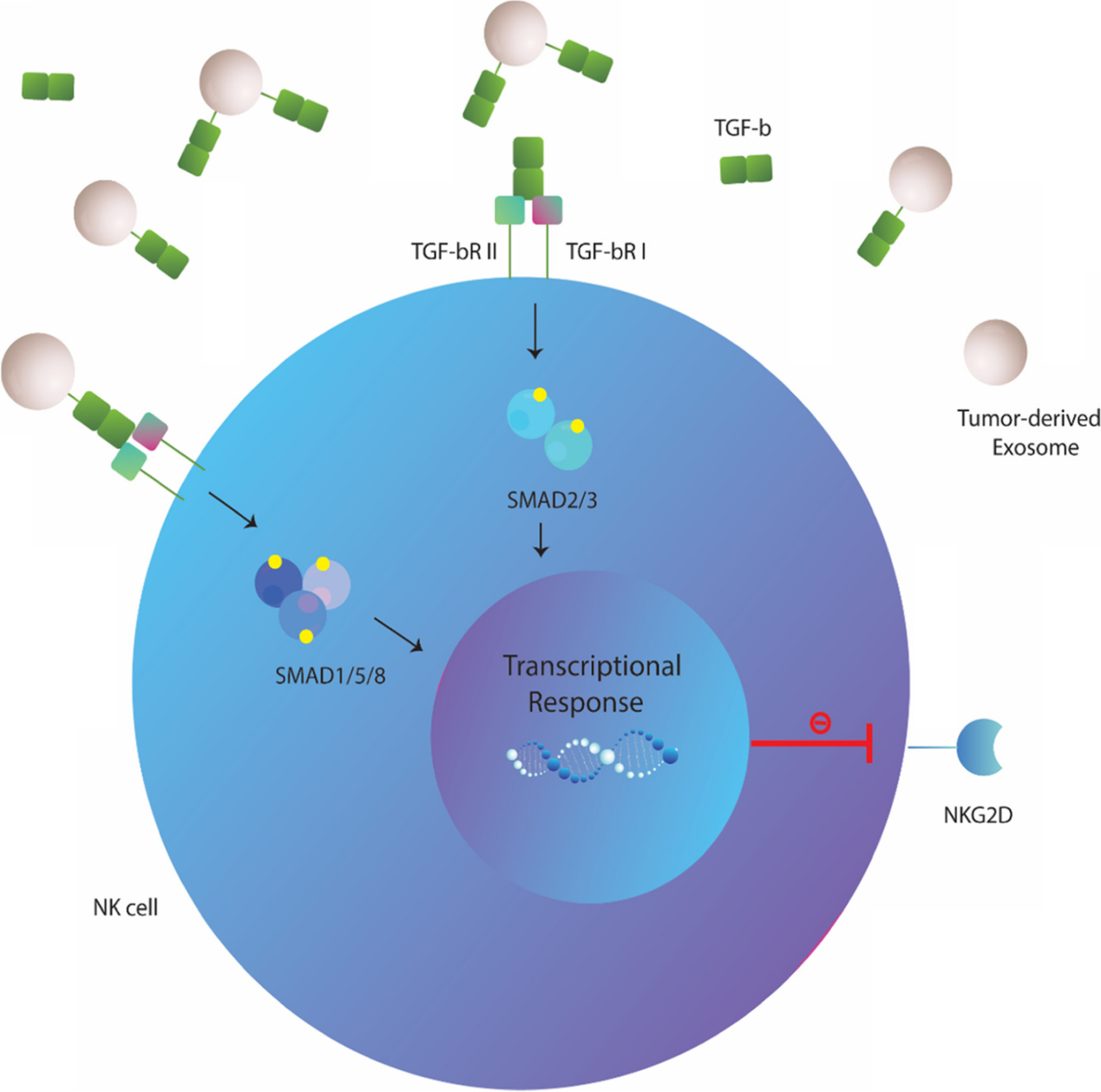
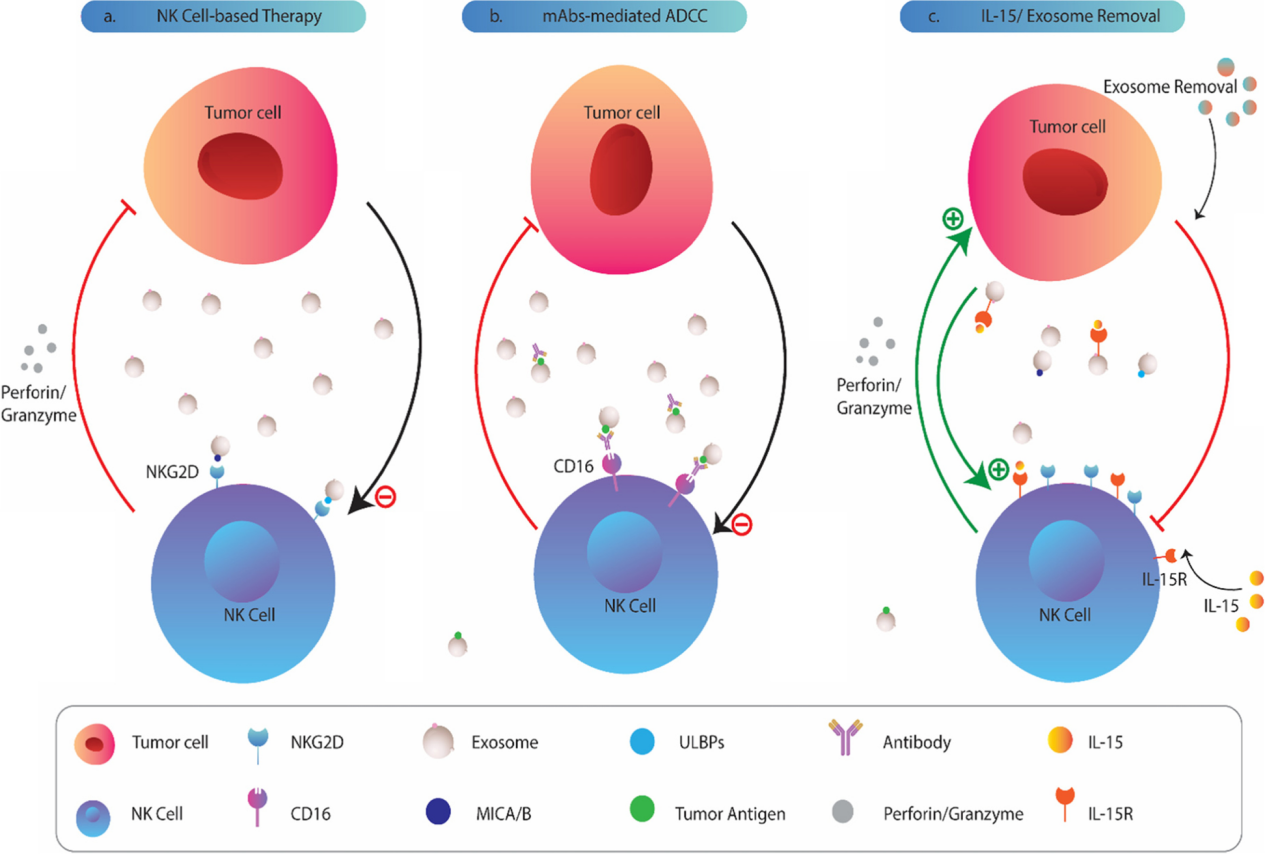
图1:肿瘤来源的外泌体对N 细胞的生物学影响。TDE可以被人NK细胞吸收或相互作用,通过表达表面趋化因子/趋化因子受体TDEs可以抑制NK细胞向肿瘤环境的募集和迁移。还可以通过降低JAK3和STAT-5的磷酸化或下调NK细胞上的IL-2R阻断IL-2对NK细胞增殖的影响。细胞溶解活性和关键细胞因子的分泌在外泌体暴露的NK细胞中也受到损害。肿瘤外泌体可以下调NK细胞上激活受体和细胞毒性介质的表达。TDEs的miRNA货物可能会改变细胞的翻译状态,导致NK细胞抑制。TDEs上CD39/CD73的共表达驱动更高水平的腺苷产生,这些腺苷可以与NK细胞上的同源A2AR受体结合,导致其代谢功能障碍。肿瘤细胞主动释放多种可溶性生物分子,如细胞因子、趋化因子和生长因子,建立肿瘤微环境。在过去的几十年中,细胞外囊泡,尤其是外泌体,被认为是肿瘤细胞与基质细胞和远处细胞交流的重要工具。新出现的证据表明,肿瘤衍生的外泌体(TDE)含有多种分子成分,包括脂质、膜相关蛋白、长链非编码RNA(lncRNA)和microRNA(miRNA),它们可以改变受体细胞的行为并提供恶性细胞生长的途径。越来越清楚的是,肿瘤外泌体参与了肿瘤形成和侵袭的几个过程,包括血管生成、增殖和生长、转移和免疫逃逸。 特别值得注意的是,有证据支持TDE是肿瘤微环境的关键免疫调节参与者。在这方面,这些肿瘤来源的颗粒被证明可以操纵先天性和适应性免疫反应,有利于肿瘤进展。大量研究表明,源自肿瘤细胞的外泌体通过损害DC、NK细胞和T细胞的功能来破坏抗肿瘤免疫。其中,NK细胞被认为是恶性细胞转化的初始反应者。尽管体内还存在着CD8+ 细胞毒性T细胞(CTL),但NK细胞不需要事先接触抗原即可识别肿瘤细胞,成为为抵御肿瘤细胞的早期防线。事实上,NK细胞表达一系列抑制性(KIR、CD94-NKG2A等)和激活性受体(NKG2D、NKp30、NKp44 和 NKp46),这决定了NK细胞的命运并使它们能够识别受体细胞上的配体。尽管主要组织相容性复合物I(MHCI)分子和激活肿瘤细胞受体的配体的低表达被认为会影响NK细胞活性,但肿瘤细胞可以通过不同的机制抑制NK细胞功能。最近的数据指出,肿瘤外泌体在NK细胞功能障碍中起关键作用。TDEs可以被NK细胞吸收或通过受体-配体相互作用诱导下游信号,下调其抗肿瘤活性。还有大量证据表明,肿瘤外泌体含有过多的表面配体和生物分子,它们会干扰NK细胞的募集、细胞因子产生、分子表达和溶细胞活性。值得注意的是,TDEs也被认为可以消除基于NK的免疫疗法的有益效果 。虽然一些报道显示肿瘤衍生的细胞外囊泡具有免疫刺激作用,但研究人员还主要关注它们的抑制作用并回顾TDEs在NK细胞功能障碍中的作用与机制见解,并总结临床意义和治疗方法,以对抗外泌体依赖性肿瘤诱导的NK细胞失活。图2:肿瘤来源的外泌体和NK细胞之间的免疫突触。肿瘤细胞向肿瘤微环境和循环中释放大量免疫抑制性外泌体,这些外泌体可以与NK细胞相互作用,并将其抑制性内容传递到这些细胞中。大量的生物分子,包括 MICA/B、ULBP、PD-L1、Fas-L、TGF-b 和 B7-3 存在于外泌体上,它们可以与NK细胞上的同源受体结合并诱导下游信号传导,抑制其抗肿瘤活性。图3:外泌体转化生长因子-β(TGF-β) 诱导NK细胞功能障碍。TDE含有更高水平的膜相关成熟TGF-β,可以脱离细胞增加肿瘤微环境中的TGF-β水平,与NK细胞上的TGF-bRI/TGF-bRII 结合,导致SMAD2/3或SMAD1/5/8磷酸化,最后引起NKG2D的低表达。 图4:肿瘤外泌体在NK细胞治疗中的临床意义和潜在治疗方法。 参考文献:Cancer exosomes and natural killercells dysfunction: biological roles, clinical significance and implications forimmunotherapy. Mol Cancer. 2022 Jan 14;21(1):15.外泌体资讯网 【综述】Mol Cancer:肿瘤外泌体在介导自然杀伤细胞功能障碍中的生物学作用