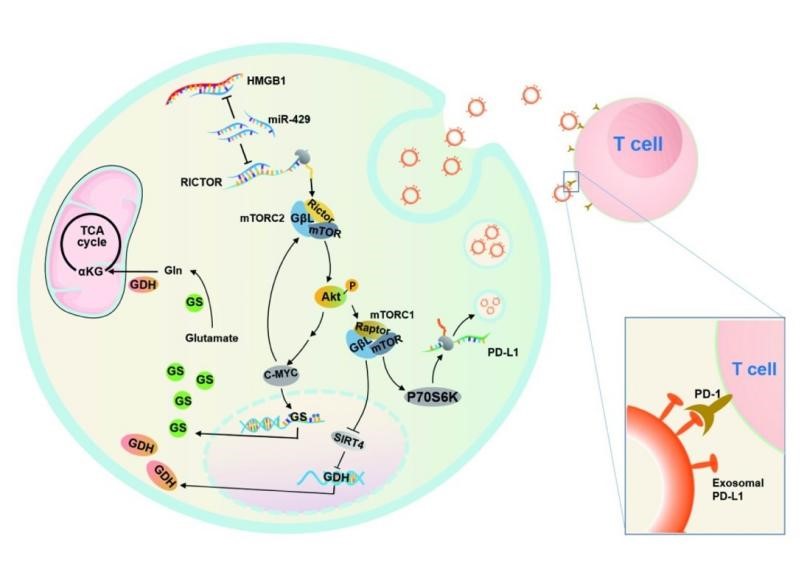
RNA转录本之间通过microRNA反应元件(MREs)竞争相同的microRNA从而调节其他转录本的表达,这种新的相互调节、通讯的形式被称为竞争性内源性RNA(ceRNAs)机制,这说明mRNA不仅可以编码蛋白,还具备反式调节其他mRNA的作用。核因子HMGB1的过表达和分泌被证实与多种肿瘤的发生、发展密切相关,但是其在肝脏炎症以及肝癌中的作用研究基本聚焦在蛋白编码功能上,而其作为ceRNA是否发挥功能目前尚未可知。图1 HMGB1和RICTOR 介导的RNA-RNA 胞间通讯近日,来自海军军医大学国家肝癌科学中心王红阳院士科研团队的研究人员利用生物信息学方法,对包含HMGB1的ceRNA网络进行了预测,通过在早期肝癌样本中进行表达检测及相关性分析,发现mTOR通路中重要分子RICTOR可能是HMGB1的ceRNA。相关研究成果以“An RNA-RNAcrosstalk network involving HMGB1 and RICTOR facilitates hepatocellularcarcinoma tumorigenesis by promoting glutamine metabolism and impedesimmunotherapy by PD-L1+ exosomes activity”为题发表在国际知名期刊Signal Transduction and TargetedTherapy上(2021, 6:421)。海军军医大学国家肝癌科学中心王红阳院士、李亮研究员以及东南大学附属中大医院程张军教授为论文的共同通讯作者,海军军医大学国家肝癌科学中心危晏平博士为论文第一作者。研究人员发现,干扰HMGB1 mRNA降低RICTOR mRNA的表达,过表达HMGB1 3’UTR,能够升高RICTOR mRNA的表达,提示HMGB1与RICTOR之间存在ceRNA调控关系。通过分析紫外交联免疫沉淀结合高通量测序(CLIP seq)数据、报告基因实验及FISH实验,研究人员发现miR-200家族成员中的miR-429可以介导HMGB1对RICTOR的ceRNA调控。功能方面,HMGB1通过ceRNA机制调控RICTOR的表达,能够促进肝癌的自我更新、恶性增殖和体内肿瘤形成。有意思的是,这种调控形式还能够通过促进PD-L1+外泌体的产生抑制肝癌抗PD-L1免疫治疗的疗效。在机制方面,HMGB1驱动的RNA-RNA交互对话通过下游双通路调控谷氨酰胺代谢和肝癌发生:1. 激活mTORC2-AKT-C-MYC的正反馈环路以上调谷氨酰胺合成酶(GS)的表达;2. 诱导mTORC1信号活化,解除SIRT4对谷氨酸脱氢酶(GDH)的抑制性作用。同时,这种交互对话可通过mTORC1-P70S6K依赖的PD-L1产生和PD-L1+外泌体活性阻碍肝癌免疫治疗的效果。该项研究通过对HMGB1基因编码蛋白之外新的非编码作用形式的研究, 有望拓展对HMGB1在肝癌发生中作用的认识;且通过对ceRNA机制调控能量代谢、免疫治疗反应的研究,有望为肝癌临床治疗提供新的靶标和疗效预测标志物。An RNA-RNA crosstalk network involving HMGB1 and RICTOR facilitateshepatocellular carcinoma tumorigenesis by promoting glutamine metabolism andimpedes immunotherapy by PD-L1+ exosomes activity. Signal TransductTarget Ther, 2021,17;6(1):421.外泌体资讯网 RNA-RNA交互网络促进谷氨酰胺代谢诱导肝癌发生,并通过PD-L1+外泌体阻碍肝癌免疫治疗