随着世界人口的增加,阿尔茨海默病(AD)的发病率也在增加,给患者造成严重的身体痛苦和经济负担。研究表明,β-淀粉样蛋白 (Aβ) 的过度沉积是AD病理学中的诱发事件。因此,靶向Aβ的分解被认为是治疗AD的重要干预措施之一,各种针对Aβ的靶向药物已进入临床试验,但通常表现出中度至低度的临床成功率,这些失败使Aβ靶点引起争议。然而,大量的病理证据表明,关键问题不在于Aβ不合适作为治疗靶点,而是与Aβ相关的各种病理途径的干扰作用被低估了。如淀粉样斑块的出现和神经元变性,经常与氧化应激和神经炎症同时发生,多种病理因素的恶性循环加速了AD的进展,导致单靶点药物难以满足AD的治疗需求。此外,大多数抗AD候选药物未能穿过血脑屏障(BBB),并且无法特异性靶向AD病变区域,严重限制了其在临床上的治疗效果。因此,理想的AD治疗策略应该能够有效克服BBB的阻碍,积极靶向AD病灶,同时对抗AD的多种病理。
湖南大学化学化工学院王青教授团队在Biomaterials杂志上发表题为“Multi-targeted Engineered Hybrid Exosomes as Aβ Nanoscavengers and Inflammatory Modulators for Multi-pathway Intervention in Alzheimer's Disease”的研究论文。该研究主要设计并合成了一种基于膜融合的工程化外泌体(RPDA@Rb-A),具有多重靶向和多环节干预AD的功能,为工程化外泌体在AD和其他神经退行性疾病中的药物设计提供了新思路。湖南大学化学化工学院王青教授为通讯作者。
该研究利用膜融合、膜靶向修饰和药物装载技术合成工程化外泌体,并对该工程化外泌体的逐级靶向和AD干预能力进行了研究。通过将脑微血管内皮细胞外泌体和巨噬细胞外泌体的膜杂交,并将聚多巴胺纳米颗粒、白藜芦醇和Aβ靶向适配体相结合,构建具有多重靶向能力的工程外泌体(RPDA@Rb-A)来干预Aβ清除并调节小胶质细胞功能障碍。基于脑微血管内皮细胞外泌体的归巢作用和巨噬细胞外泌体的天然炎症靶向能力,RPDA@Rb-A捕获Aβ聚集体后,可以很容易地穿透血脑屏障并积聚在脑炎症部位。RPDA@Rb-A可通过多种途径有效干预AD,包括通过近红外激光照射诱导的局部加热降解有毒的Aβ聚集体并减轻神经毒性,通过捕获Aβ促进小胶质细胞清除Aβ,并通过高效递送小分子药物调节小胶质细胞诱导的神经炎症(图1A)。
图1. RPDA@Rb-A的制备及多环节干预AD的示意图
为确定RPDA@Rb-A在体内的生物分布,该研究通过尾静脉对C57BL/6J小鼠注射Cy5标记的RPDA和RPDA@Rb-A,并进行体内荧光成像以评估其大脑靶向效率。在活体小鼠中,Cy5标记的RPDA和RPDA@Rb-A的脑荧光信号在给药4 h时达到最大强度,然后逐渐下降。在此期间,RPDA@Rb-A在大脑中的积累高于RPDA,表明外泌体的涂层增强了RPDA@Rb-A的大脑靶向能力,应用NIR辐照可以进一步增加RPDA@Rb-A在大脑中的富集(图2A和2C)。然后,对分离的主要器官进行荧光成像。如图2B和2D所示,发现脑组织中的个体荧光差异与体内成像结果一致。给药4 h后,RPDA@Rb-A在肝脏中的积累少于RPDA,进一步证实了RPDA@Rb-A的抗巨噬细胞吞噬作用。采用APP/PS1转基因AD小鼠模型评价RPDA@Rb-A体内治疗效果,通过莫里斯水迷宫(MWM)实验评估小鼠的空间学习和记忆能力。结果显示,AD小鼠和RPDA处理的小鼠分别表现出漫无目的的探索行为和认知行为的轻微改善;与其他组相比,RPDA@Rb-A+NIR处理组的小鼠在目标象限中游泳的时间更长,寻找隐藏的平台的时间更少,平台穿越次数增加(图2E),表明RPDA@Rb-A显着改善了AD小鼠的空间记忆功能。行为评估后,对小鼠实施安乐死,收集其脑组织,检测RPDA@Rb-A对AD小鼠病理的多环节干预能力。Aβ免疫荧光染色结果表明,与AD小鼠相比,用RPDA@Rb-A+NIR治疗的AD小鼠的Aβ斑块数量显着减少,表明RPDA@Rb-A给药可有效减轻AD脑中的Aβ负荷(图2F)。iNOS免疫荧光染色结果表明,与AD小鼠相比,RPDA@Rb-A+NIR处理后,AD小鼠海马和大脑皮层中iNOS的红色荧光信号显著降低,表明RPDA@Rb-A可以有效减轻AD小鼠的神经炎症(图2G)。以上结果表明利用多重靶向修饰和多药物装载获取的工程化外泌体具有高效干预AD的潜力。
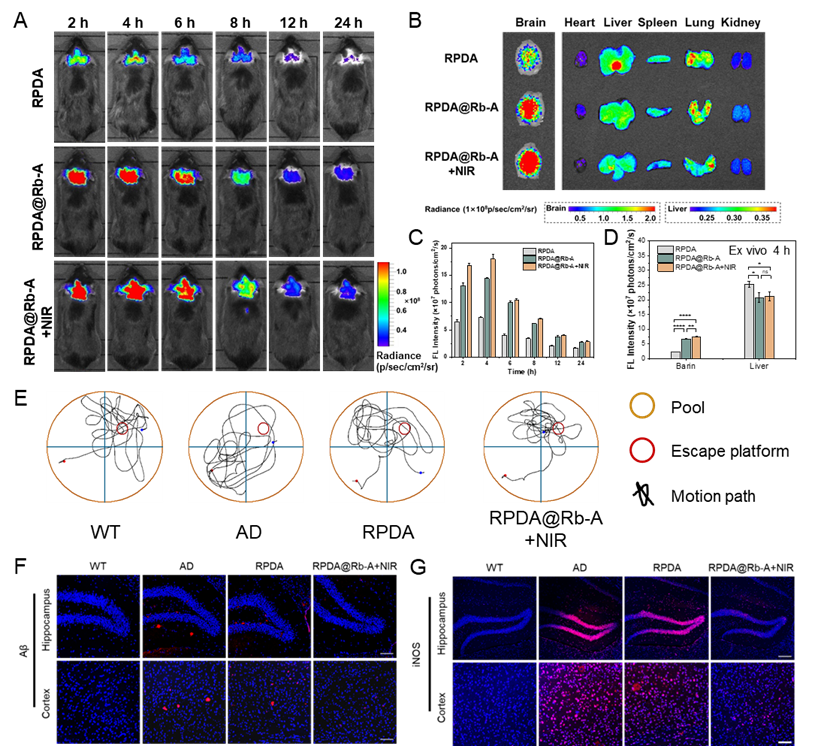
图2 (A)在指定时间点用Cy5标记的RPDA或RPDA@Rb-A(有或没有 NIR)给药的C57BL/6J小鼠的体内荧光图像和(C)在指定时间点对脑荧光强度的定量分析;(B)主要器官的离体荧光图像和(D)给药后4 h脑和肝脏的定量荧光分析;(E)MWM中不同处理小鼠的代表性轨迹;离体脑切片海马和皮层区域(F)Aβ斑块和(G)iNOS的免疫荧光图像,Aβ斑块和iNOS(红色),细胞核(蓝色)。
参考文献:
Multi-targeted engineered hybrid exosomes as Aβ nanoscavengers and inflammatory modulators for multi-pathway intervention in Alzheimer’s disease. Biomaterials 2025, DOI: 10.1016/j.biomaterials.2025.123403.
外泌体资讯网 Biomaterials|湖南大学王青教授:多重靶向的工程化杂合外泌体作为Aβ纳米清除剂和炎症调节剂用于AD的多环节干预






