近日, 上海交通大学医学院附属新华医院赵敬军教授/同济大学附属同济医院欧庆健团队在Journal of Autoimmunity杂志上发表题为“miR-143-3p boosts extracellular vesicles to improve the dermal fibrosis of localized scleroderma”的论文,主要聚焦于局限性硬皮病(LoSc)的皮肤纤维化治疗机制,提出通过骨髓间充质干细胞(BMSCs)衍生的细胞外囊泡(EVs)中富集的miR-143-3p改善病理进程的新策略。第一作者为金佳慧博士,通讯作者为欧庆健助理教授和赵敬军教授。
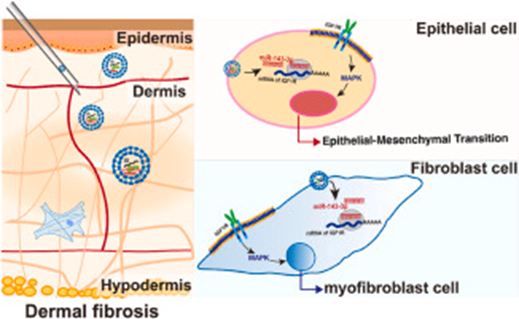
局限性硬皮病以皮肤胶原过度沉积和成纤维细胞异常分化为特征,目前缺乏有效疗法。作者团队基于前期十余年的研究中BMSC和BMSC-EVs的治疗潜力,进一步探索其作用机制,发现miR-143-3p是EVs发挥抗纤维化功能的关键因素之一(图1)。
图1 文章机制图
研究首先通过miRNA测序筛选出BMSC-EVs中高表达的miR-143-3p,并在临床患者和小鼠模型中发现该分子在病变皮肤中显著下调(图2)。体外实验表明,miR-143-3p能抑制成纤维细胞向肌成纤维细胞分化,减少胶原蛋白(Col1、Fn1)和α-平滑肌肌动蛋白(α-SMA)的表达。进一步通过构建miR-143-3p过表达或抑制的BMSC-EVs,发现富含miR-143-3p的EVs在LoSc小鼠模型中展现出更强的治疗效果,包括减轻真皮层增厚、减少胶原沉积、恢复皮下脂肪层结构,并抑制TGF-β1介导的纤维化信号通路。

图2.临床病理组织分析图
miR-143-3p通过靶向胰岛素样生长因子1受体(IGF1R)的3-非编码区,抑制其表达,进而阻断IGF1/IGF1R-AKT/MAPK信号通路的激活。单细胞RNA测序分析显示,LoSc患者皮肤中成纤维细胞和上皮细胞的IGF1R表达升高,且与MAPK通路和上皮-间质转化(EMT)相关基因富集相关(图3)。动物实验中,miR-143-3p增强的EVs显著降低磷酸化AKT、ERK1/2和P38水平,证实其通过调控该通路改善纤维化。
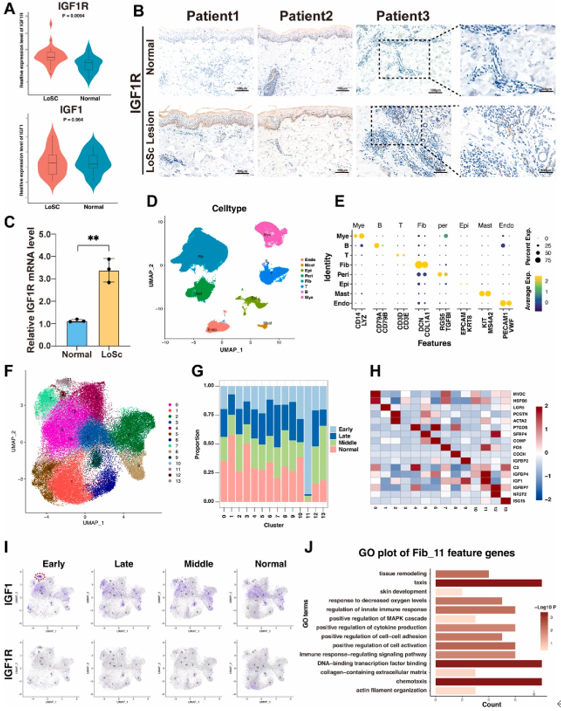
图3. IGF1R在疾病组织各细胞中的分布
该研究揭示了miR-143-3p在BMSC-EVs介导的抗纤维化作用中的核心地位,并提出工程化改造EVs以富集特定miRNA的创新治疗思路。此外,通过结合临床样本、动物模型和多组学分析,系统验证了miR-143-3p-IGF1R轴的科学性与可行性。该研究为LoSc的精准治疗提供了新靶点,也为基于EVs的核酸药物递送系统开发提供了理论基础。
参考文献:
miR-143-3p boosts extracellular vesicles to improve the dermal fibrosis of localized scleroderma. Journal of Autoimmunity.2025 Apr 23:153:103422
文章链接:
https://authors.elsevier.com/a/1k%7E0t3BwmOhFNc
外泌体资讯网 J AUTOIMMUN|上海交大附属新华医院赵敬军/同济大学附属同济医院欧庆健:富集miR-143-3p的EVs治疗局限性硬皮病