血管内皮损伤是动脉粥样硬化等心血管疾病的发病始动因素和共同病理基础。内皮祖细胞(Endothelial Progenitor Cells, EPC)来源于骨髓,能够迁移至血管损伤部位并分化为血管内皮细胞,从而促进血管修复与新生血管形成。近年来研究发现,EPC并不主要通过直接归巢分化发挥作用,而是依靠其分泌的外泌体(Exosomes from EPCs, EPC-Exo)在局部微环境中介导细胞间通讯,发挥强效的旁分泌修复功能。然而,EPC-Exo在临床转化中面临诸多瓶颈,如提取困难、产量低、生物利用度有限等问题,限制了其进一步应用。
补阳还五汤(Buyang Huanwu Decoction, BYHWD)作为传统益气活血方,其中黄芪甲苷、苦杏仁苷和芍药苷三种苷类活性成分(Astragaloside IV, Amygdalin, Paeoniflorin,简称AAP)是该方剂的代表性药效成分,被认为具有与母方一致的血管保护潜力。
湖南中医药大学中西医结合学院张伟教授团队在Phytomedicine杂志上发表题为“Glycoside components promote endothelial progenitor cell-derived exosomes repairing damaged vascular endothelium via the PI3K/AKT signaling pathway”的研究论文。湖南中医药大学中西医结合学院谭维为论文的第一作者,湖南中医药大学中西医结合学院张伟、邓常清教授为共同通讯作者。
该研究聚焦于补阳还五汤(Buyang Huanwu Decoction, BYHWD)中的苷类成分——黄芪甲苷、苦杏仁苷和芍药苷(Astragaloside IV, Amygdalin, and Paeoniflorin, AAP)与EPC-Exo在血管内皮修复中的协同效应。研究团队在成功提取并鉴定EPC及其外泌体后,分别构建了颈动脉球囊损伤模型及POVPC诱导的体外内皮损伤模型,从体内外两个层面系统评估AAP与EPC-Exo联合干预的修复效果。
体内实验结果显示,在颈动脉球囊损伤模型中,EPC-Exo和AAP均能有效减轻内膜增生,改善血管狭窄,改善血管内皮功能。联合应用AAP与EPC-Exo较单独用药具有更明显的内膜增厚抑制和血管保护效果。同时,两者联合干预能明显提升血管内皮标志物CD31的表达,促进内皮再生;血管生成相关蛋白Ang-1与VEGF表达水平均得到显著改善,提示其可有效促进血管新生,维护内皮完整性。
体外实验进一步验证了上述发现。通过CCK-8、划痕实验及血管形成实验发现,POVPC处理显著抑制血管内皮细胞增殖、迁移及血管形成能力,而AAP与EPC-Exo均能有效逆转这一损伤作用,联合用药效果更加显著。尤其值得注意的是,PKH26标记实验显示,AAP能显著增强VEC对EPC-Exo的摄取,这意味着AAP不仅具有直接修复作用,还能“助力”EPC-Exo在细胞内的功能发挥,是一种有效的功能增强因子。此外,AAP与EPC-Exo共同干预可显著降低Cleaved-caspase 3表达,抑制内皮细胞凋亡,并上调eNOS、Ang-1、VEGF等蛋白的表达。机制研究方面,通过网络药理学分析和分子对接发现,PI3K/AKT信号通路在其中可能发挥核心调控作用。进一步使用PI3K抑制剂LY294002干预发现,该通路的阻断显著削弱了AAP+EPC-Exo的修复效果,证实PI3K/AKT信号是其发挥协同作用的重要机制通路。
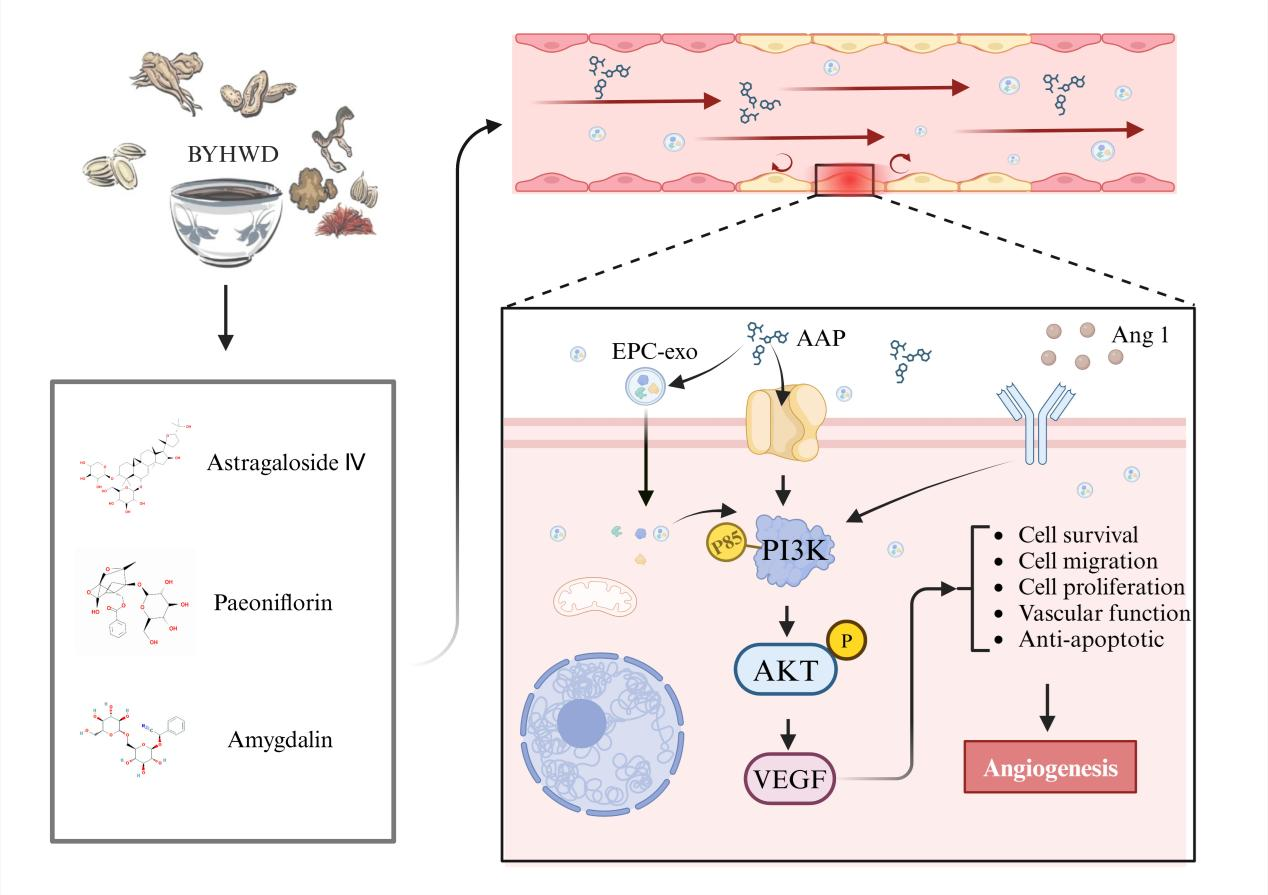
综上所述,AAP与EPC-Exo具有良好的协同作用,通过增强外泌体摄取、激活PI3K/AKT信号通路,有效促进血管内皮细胞增殖、迁移与血管新生,修复血管损伤。该研究为中药活性成分与外泌体联合干预血管内皮损伤提供了新策略,也为心血管疾病的精准防治提供了新的理论支撑。
参考文献:
Glycoside components promote endothelial progenitor cell-derived exosomes repairing damaged vascular endothelium via the PI3K/AKT signaling pathway.Phytomedicine. Published online March 26, 2025. doi:10.1016/j.phymed.2025.156694
外泌体资讯网 Phytomedicine |湖南中医药大学中西医结合学院张伟教授团队:苷类组分通过 PI3K/AKT 信号通路促进内皮祖细胞外泌体修复损伤血管内皮





