胶质母细胞瘤(Glioblastoma,GBM)是最具侵袭性的胶质瘤类型,GBM患者的中位无进展生存期仅为7个月,中位总生存期仅为14.6-20.5个月。肿瘤微环境中血脑屏障(BBB)的存在和缺氧是导致GBM对传统化疗耐药性的关键因素,尽管已经出现了不少有效的治疗方法,但GBM患者的生存率在过去二十年中并没有显著提高,迫切需要颠覆性技术来彻底改变肿瘤治疗。而基于纳米颗粒的药物递送可能成为一种颠覆性的技术工具,通过增强渗透和保留(Enhanced Penetration and Retention,EPR)效应改善药物的药代动力学和肿瘤沉积来增强治疗功效并减少毒副作用。
近日,山东大学齐鲁医院神经外科李刚教授和薛皓教授,山东大学晶体材料研究所刘宏教授和济南大学化学与化学工程学院周伟家教授团队在国际期刊Materials Today Bio(中科院1区,IF=8.8)上发表题为“Engineering exosome membrane disguised thermal responsive system for targeted drug delivery and controlled release across the blood-brain barrier”的论文。该研究通过构建基于工程化外泌体膜仿生的光热响应性纳米载药体系,实现了脑胶质瘤的精准靶向和大分子药物的控制释放,为胶质瘤的多模态治疗提供了新的思路和方法。
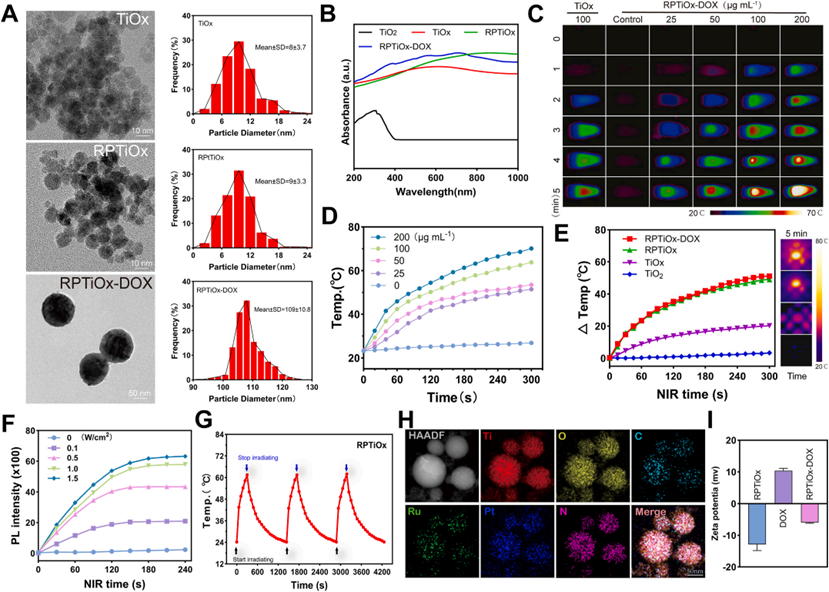
研究首先通过激光轰击钛粉在Ar/O₂混合气体中制备了富含氧空位的缺陷型TiOx纳米颗粒。随后通过吸附Ru和Pt,经还原生成复合Ru/Pt-TiOx(RPTiOx)纳米颗粒,其具有优异的光热转换效率(63.8°C/5 min)和催化产氧性能。通过紫外-可见-近红外光谱和HRTEM证实了Ru和Pt的均匀负载及晶格结构。并将阿霉素与月桂酸结合负载于RPTiOx表面形成RPTiOx-DOX复合物,利用动态光散射和Zeta电位分析验证其粒径及药物稳定负载;元素映射显示Ti、O、Ru、Pt、C和N的均匀分布,表明载药成功。
图1 RPTiOx-DOX双金属氧化物的合成与表征
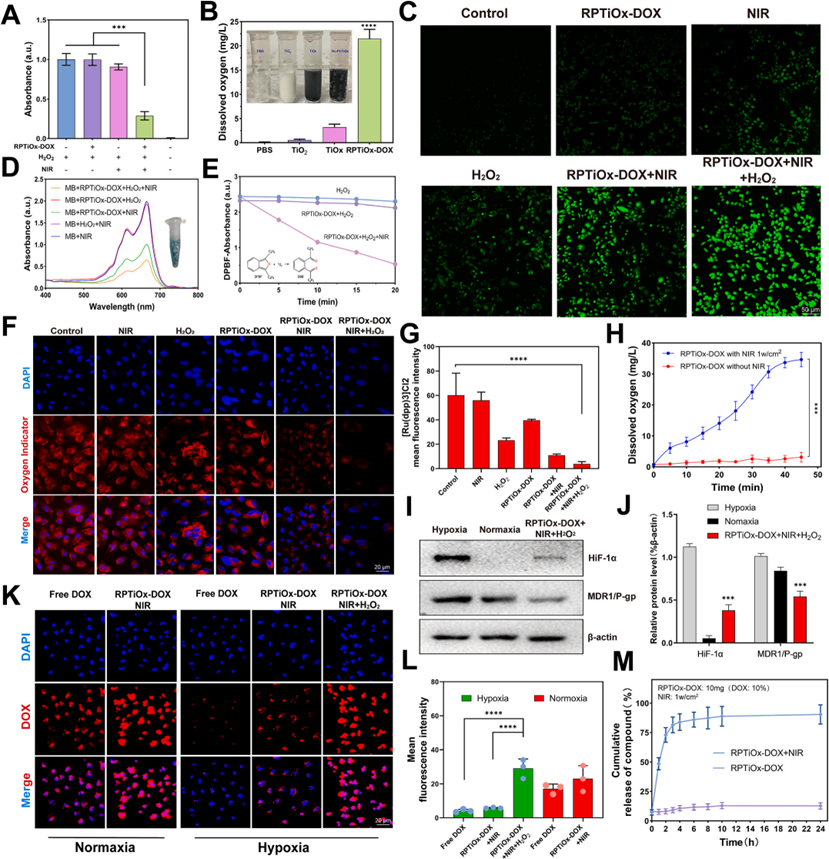
在NIR照射下,RPTiOx-DOX通过类芬顿反应催化肿瘤内源性H2O2产氧,显著缓解缺氧微环境,并降低HIF-1α、MDR1和P-gp表达。ROS探针显示,NIR驱动的光热效应协同催化反应增强了ROS生成。月桂酸在44°C熔化触发DOX释放,4小时内累积释放80%,克服了化疗药物外排耐药性。彗星实验证实NIR刺激下DOX诱导的核损伤加剧,缺氧环境逆转提升了药物滞留率。
图2 RPTiOx-DOX可以在NIR照射下诱导肿瘤微环境中的低氧重塑,ROS产生和反应性药物释放
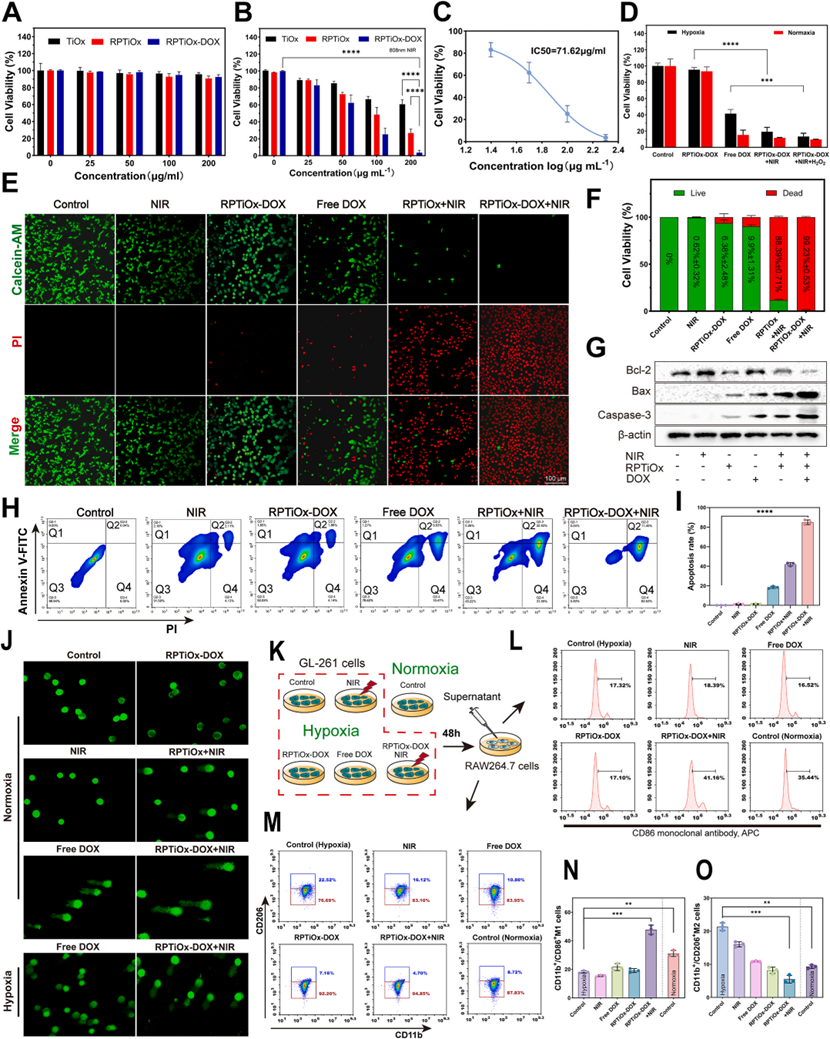
CCK-8实验表明,RPTiOx-DOX在NIR下对GL-261胶质瘤细胞的杀伤率可达99.2%,IC50为71.62 μg/mL。Calcein-AM/PI双染色和流式细胞术显示NIR组细胞凋亡率显著升高。Western blot显示Bax/Bcl-2比值上升及Caspase-3激活,证实线粒体凋亡通路激活。缺氧条件下,RPTiOx-DOX通过产氧减少M2型巨噬细胞标志物CD206表达,促进M1型极化,增强免疫抗肿瘤效应。
图3 体外研究纳米载体系统的细胞毒性,抗肿瘤效应和诱导巨噬细胞极化
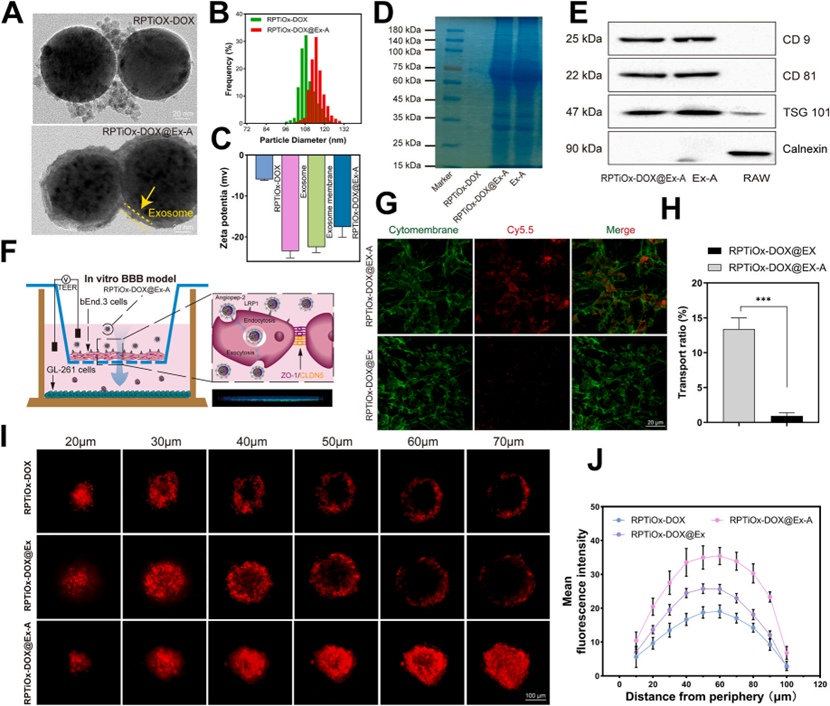
利用Angiopep-2修饰的巨噬细胞外泌体膜包裹RPTiOx-DOX,形成RPTiOx-DOX@Ex-A纳米颗粒。TEM显示了包裹后的双层膜结构,Western blot验证了外泌体标志蛋白CD9、CD81和TSG101的保留。体外BBB模型中,修饰组穿透率(13.4%)显著高于未修饰组(0.9%)。肿瘤球体共培养实验显示,RPTiOx-DOX@Ex-A可深层渗透至球体核心,靶向性依赖LRP-1受体介导的内吞作用。
图4 工程巨噬细胞外囊泡膜封装的纳米药物输送系统的构建及其穿透血脑屏障的能力
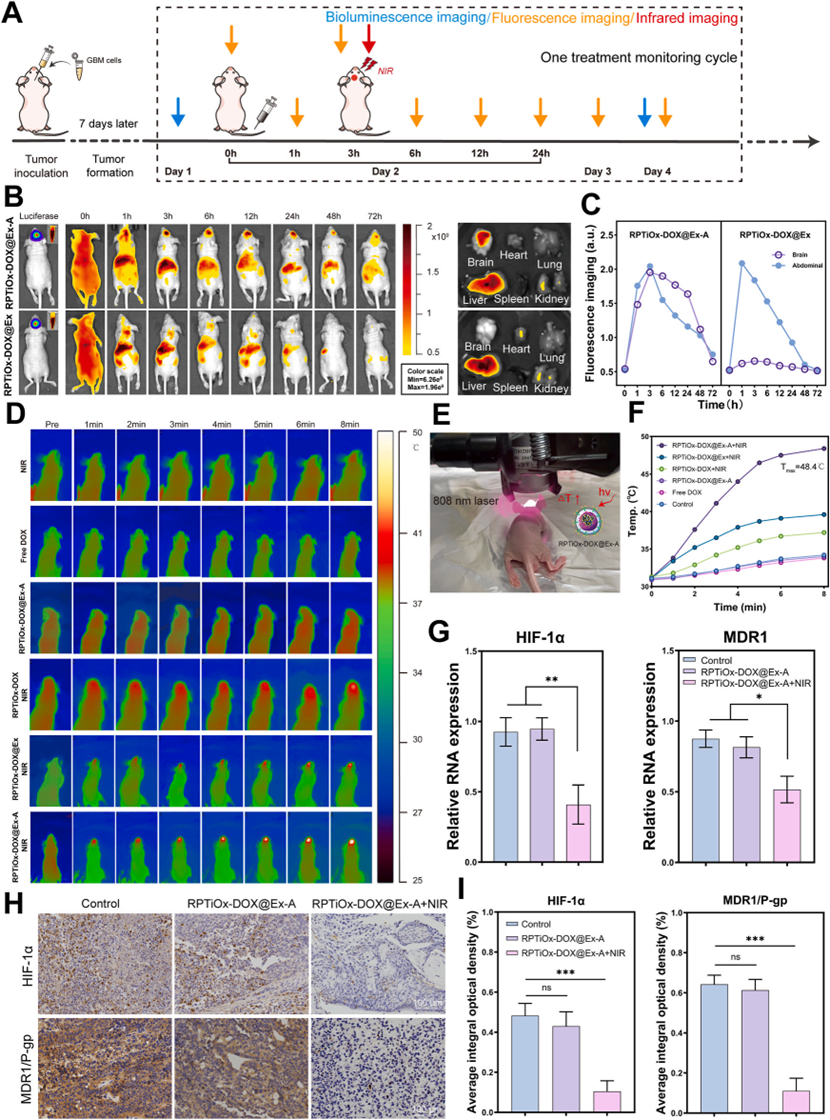
活体成像显示,尾静脉注射后3小时,Cy5.5标记的RPTiOx-DOX@Ex-A在脑肿瘤区域富集,24小时内维持有效浓度。NIR照射下颅内温度升高至48.4°C,触发DOX释放并催化产氧,降低肿瘤组织HIF-1α和P-gp表达。流式细胞术显示瘤内M1型巨噬细胞比例升高,M2型减少,重塑免疫抑制微环境。
图5 体内研究验证纳米材料穿透血脑屏障,靶向肿瘤区域并调节肿瘤微环境的能力
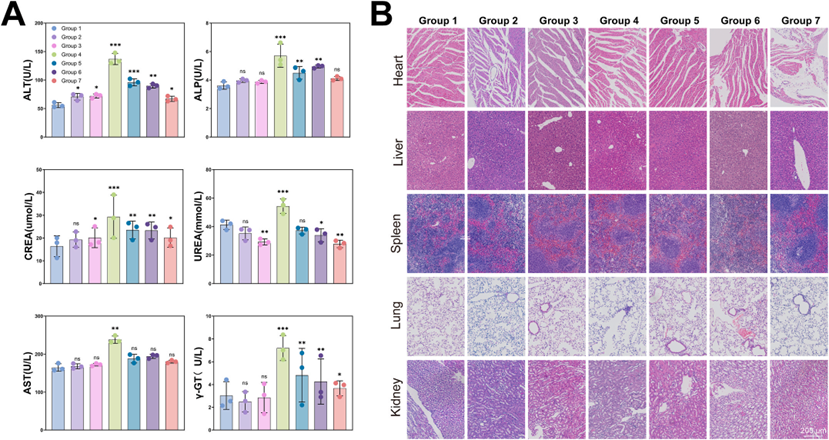
原位胶质瘤模型显示,RPTiOx-DOX@Ex-A联合NIR治疗组小鼠生存期延长至30天,生物发光成像和MRI显示肿瘤体积抑制率达81.2%。TUNEL和HE染色显示了广泛的肿瘤细胞凋亡和坏死,Ki-67染色提示增殖抑制。心肝肾功能指标和器官HE切片证实了系统安全性良好,无显著毒副作用;且RPTiOx-DOX@Ex-A在血液、PBS和培养基中稳定性良好。血生化分析显示,与游离DOX相比,该纳米系统未引起肝肾损伤。主要器官染色未见炎性病变或组织损伤,证实其生物相容性,具备临床转化潜力。
图6 纳米药物输送系统的体内生物安全性研究
该研究成功构建了Ang2修饰的外泌体膜伪装热响应纳米载药系统(RPTiOx-DOX@Ex-A),该系统具有穿透血脑屏障、NIR触发DOX控释、催化肿瘤微环境产氧及诱导M1巨噬细胞极化的能力,实现了化疗-光热/光动力-免疫的多模式协同抗胶质瘤效应,同时具备高生物安全性,为脑肿瘤靶向治疗提供了创新策略。

图7 纳米载体系统的合成示意图以及纳米材料在体内靶向神经胶质瘤区域并被近红外激活释放DOX的过程
参考文献:
Engineering exosome membrane disguised thermal responsive system for targeted drug delivery and controlled release across the blood-brain barrier. Mater Today Bio. 2025 Mar 11;32:101656. doi: 10.1016/j.mtbio.2025.101656.
外泌体资讯网 Materials Today Bio |山东大学齐鲁医院李刚、薛皓教授团队:工程外泌体膜伪装热响应系统可用于靶向药物透过血脑屏障进行递送和控释