细胞外囊泡 (EV) 可以被功能化以在其表面展示特定的蛋白质受体。然而,表面展示技术通常只标记一小部分EVs。近日,瑞典卡罗林斯卡医学院(Karolinska Institutet)的研究人员在NatureBiomedical Engineering杂志上发表文章,报道表明可以通过系统地筛选EV装载的蛋白质部分来优化EV上两种不同的治疗相关蛋白质受体的联合展示。与相同细胞因子的常规疗法相比,展示细胞因子诱饵的EV能够更优地改善三种炎症小鼠模型的存活率和疾病表型,在体内引发有效的抗炎作用。
EVs作为治疗剂具有巨大的潜力,能够在功能上提供治疗性货物。先前的研究已经使用表面配体的展示在难以到达的组织(例如中枢神经系统 (CNS))中实现核酸种类的靶向递送。尽管这是一个很有前景的策略,但最近的研究突出展现了与传统内源性表面展示技术相关的局限性,因为它们通常只标记一部分EV群体,因此将靶向能力限制在一部分EV上。新出现的证据表明,除了经典的外泌体、微泡和凋亡小体之外,EV还具有许多亚群。这种异质性在EV工程中至关重要,特别是当需要结合靶向配体方法递送治疗性货物以获得成功的治疗效果时。该研究提出了一种工程策略,通过合成生物学和加载部分的系统筛选,在EV表面同时展示不同的蛋白质治疗剂。作为概念验证,该研究使用细胞外诱饵策略靶向抑制IL-6和TNF-α信号通路。各种研究都强调,这两种细胞因子在刺激炎症和组织损伤方面都具有关键作用。因此,这些途径相应地被临床使用的药物靶向,阻滞剂包括TNF-α(依那西普、英夫利昔单抗等)和IL-6受体(IL-6R)(托珠单抗),以改变自身免疫和炎症疾病中的适应性免疫反应。可溶性TNF-α同源三聚体通过与其两种受体之一——TNF受体1 (TNFR1)和TNFR2结合,发挥多种生物学功能,如细胞增殖、分化和凋亡信号传导。细胞因子IL-6具有广泛的多效性生物活性,并且已显示在失调的适应性免疫反应中发挥抗炎和促炎信号。研究强调,IL-6通过IL-6ST与可溶性IL-6R复合而激活的反式信号传导与炎症有关,而经典的IL-6顺式信号传导已被证明具有抗炎作用并参与再生过程。因此,该研究的目标是在EV上表达TNFR1和IL-6ST,作为一种临床相关的方法,使我们能够在功能水平上评估治疗性蛋白质的展示,而不仅仅是在EV表面上的存在。此外,这两种细胞因子在各种炎症性疾病中的治疗相关性使我们能够在体内研究这些受体诱饵系统的效力。研究用TNFR1和IL-6ST的细胞因子结合域对EV表面进行了多种内源性展示策略的筛选,它们可以分别作为促炎细胞因子TNF-α和IL-6的诱饵。与针对相同细胞因子的常规疗法相比,这种方法能够以多聚体形式同时展示一种以上的受体类型,并随后增强它们的抑制活性。此外,这种方法通过显著改善三种炎症小鼠模型的存活率和疾病表型,在体内引发有效的抗炎作用:脂多糖 (LPS) 诱导的全身炎症、实验性自身免疫性脑脊髓炎 (EAE) 和 2,4,6-三硝基苯磺酸(TNBS) 诱导的结肠炎,分别模拟败血症、多发性硬化 (MS) 和炎症性肠病 (IBD)。通过使用展示 IL-23 alphabody的EV有效治疗EAE,进一步证实了这种工程方法的多功能性。这项工作显示出开发基于EV的工程化组合蛋白质疗法的巨大前景,因为这种方法的灵活性能够实现治疗性蛋白质的稳健和有效的表面展示,并且还可能靶向配体。 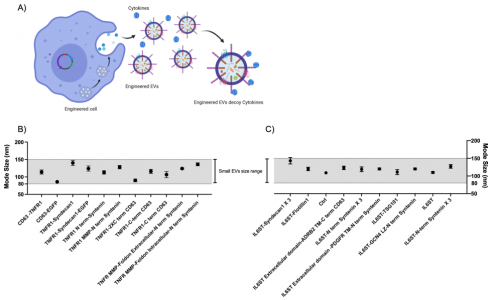
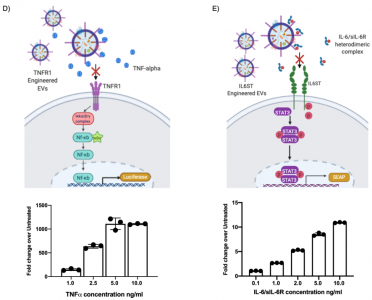
研究使用源自肿瘤坏死因子受体 1(TNFR1) 和白介素-6 信号转导器 (IL-6ST) 的细胞因子结合域,它们可以分别作为促炎细胞因子肿瘤坏死因子 α (TNF-α) 和IL-6。EV来源细胞的基因工程表达寡聚外泌体分选结构域和Syntenin的N端片段(单跨膜结构域蛋白Syndecan的胞质接头)提高了TNFR1和IL-6ST的展示效率和抑制活性并促进了他们EV上的联合展示。在全身炎症、神经炎症和肠道炎症的小鼠模型中,与临床批准的靶向TNF-α和IL-6通路的生物药物相比,展示细胞因子诱饵的EV以更高的功效改善了疾病表型。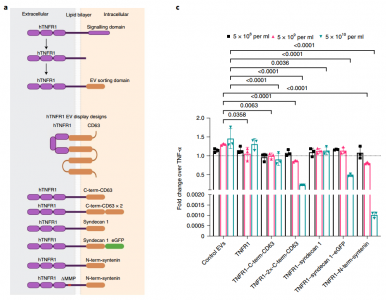
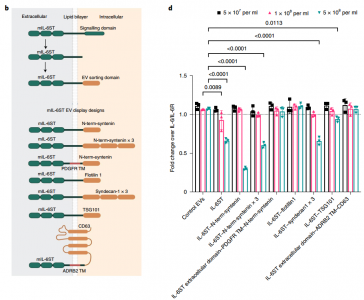
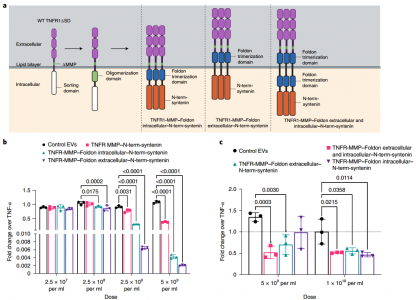
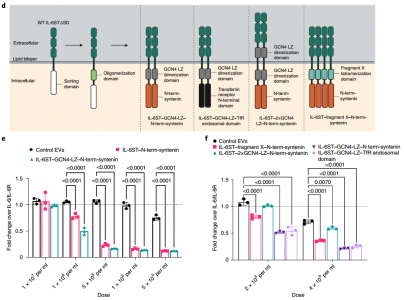
多聚诱饵受体EV分选蛋白嵌合体在几个EV亚群上被功能化
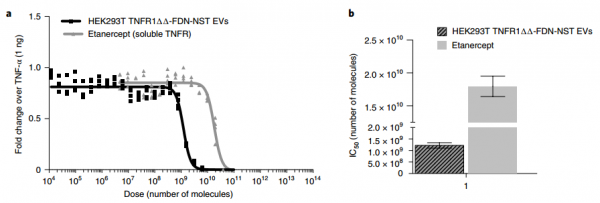
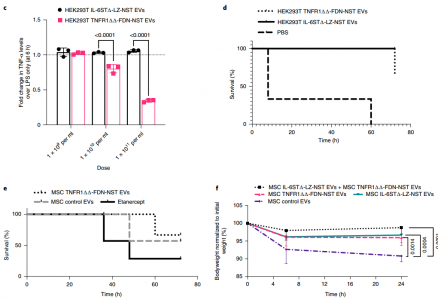
在体外和体内针对临床批准的生物制剂对工程诱饵EV进行基准测试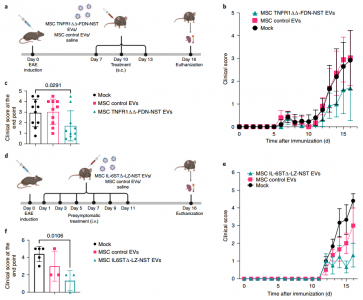
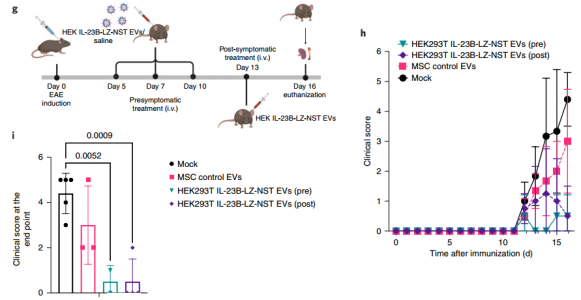
用工程诱饵EVs靶向TNF-α、IL-6和IL-23信号轴抑制神经炎症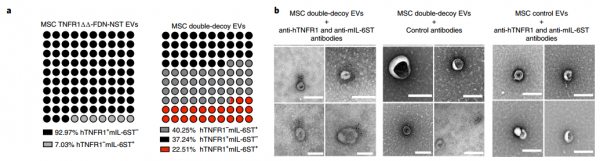
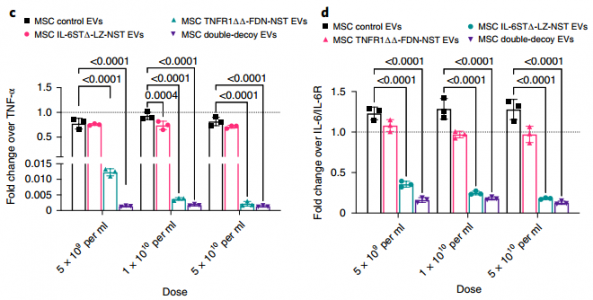
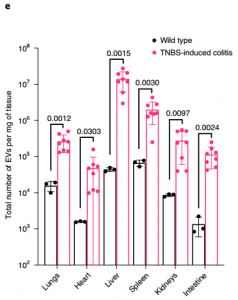
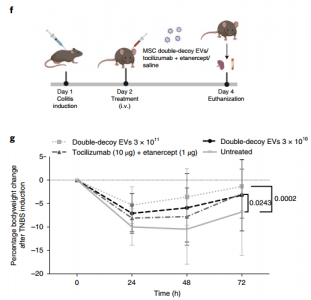
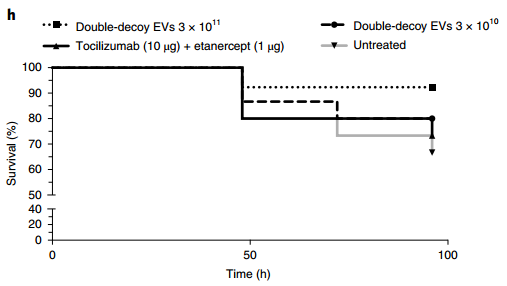
总之,该研究描述的方法有可能在几种EV工程策略中实施,以展示靶向配体、诱饵受体、单链抗体和其他治疗方式。通过进一步修改这些设计,可以同时实现囊泡内治疗性货物装载和靶向部分的展示,从而解决了释放的EV的异质性所带来的工程应用限制。通过结合蛋白质疗法和可以克服组织障碍的天然递送载体,工程化EV具有成为下一代生物疗法的巨大潜力。Gupta D, Wiklander OPB, Görgens A,Conceição M, Corso G, Liang X, Seow Y, Balusu S, Feldin U, Bostancioglu B,Jawad R, Mamand DR, Lee YXF, Hean J, Mäger I, Roberts TC, Gustafsson M,Mohammad DK, Sork H, Backlund A, Lundin P, de Fougerolles A, Smith CIE, WoodMJA, Vandenbroucke RE, Nordin JZ, El-Andaloussi S. Amelioration of systemic inflammation via the display of two different decoy protein receptors on extracellular vesicles. Nature Biomedical Engineering. 2021Sep;5(9):1084-1098. doi: 10.1038/s41551-021-00792-z. Epub 2021 Oct 6. PMID:34616047.外泌体资讯网 Nature子刊:细胞外囊泡上展示两种不同诱饵蛋白受体可改善全身炎症