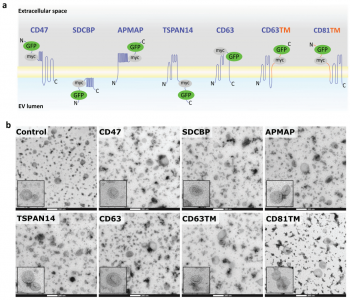
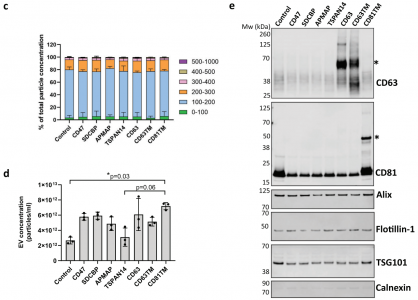
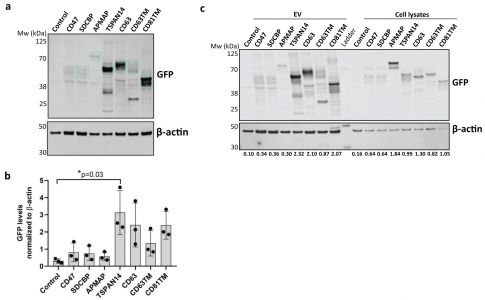
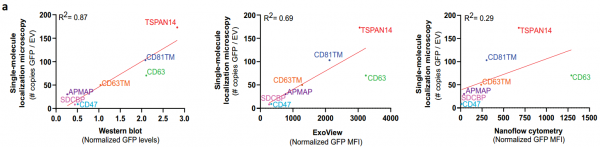
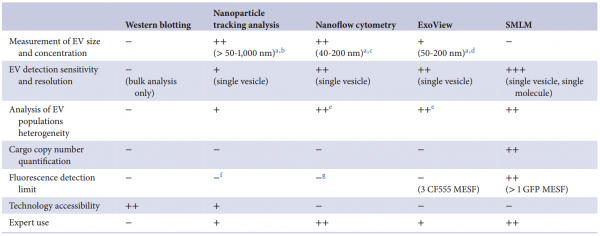
细胞外囊泡 (EVs) 已被深入探索用于蛋白质的治疗性递送。然而,缺乏量化装载到工程EVs中的货物蛋白的方法。近日,阿斯利康欧洲研发中心在Journal of Extracellular Vesicles杂志上发表文章,报道了单囊泡和单分子水平的EV分析工作流程,以准确量化不同EV分选蛋白在促进货物装载到EVs中的效率。 细胞外囊泡 (EVs) 是几乎所有细胞类型都分泌到细胞外空间或体液中的纳米级颗粒,通过生物分子的功能转移来传递细胞间通讯。EVs已被探索为用于治疗人类疾病的治疗药物分子的天然递送载体。事实上,EVs已显示出作为各种类型治疗性货物的细胞内递送的新型候选物的巨大潜力,包括合成小分子和生物分子,如RNA和大蛋白质。此外,与合成递送系统相比,这些囊泡具有几个优点,包括体积小、免疫原性低、无细胞毒性、长期安全性以及通过多种策略装载货物。EVs可以被设计,用感兴趣的分子来改变它们的货物组成。特别是,蛋白质货物对EVs的修饰通常是通过细胞工程实现的,质粒编码和过表达融合到腔内或膜蛋白的目标蛋白,在它们的生物发生过程中自然掺入EV。为此目的选择的EV蛋白通常富含于EV制剂,有可能促进高水平的选择性货物装载到囊泡中,因此,这里被指定为EV分选蛋白。常用的EV分选蛋白包括四跨膜蛋白(尤其是CD63、CD9和CD81)、lamp2b和乳粘素的C1C2结构域。选择的货物蛋白与EV分选蛋白的融合是最常报道的通过亲本细胞工程将蛋白质货物加载到EV中的策略。这种方法既可以在腔内储存可以输送到靶细胞的货物,也可以在EV表面展示货物,通过与靶细胞表面受体的直接相互作用来增强它们的治疗信号特性或靶向能力。据报道,已成功加载到EV中的蛋白质货物包括用于体外和体内EV跟踪的荧光素酶和荧光蛋白、用于EV靶向的抗体和肽、活性酶、用于同时将RNA加载到EV中的RNA结合蛋白和疫苗免疫原等。有趣的是,其中许多研究表明,装载到EV中的货物蛋白的富集水平取决于所使用的EV分选蛋白。然而,对不同EV分选蛋白的装载效率的综合比较仍仅限于少数候选蛋白,由于缺乏对货物装载进行定量分析的工具而进一步受到影响。细胞中有多种生物发生途径导致EV的释放,这解释了在细胞条件培养基中存在具有不同成分的异质囊泡群。即使是通过目前可用的最具体的方法分离的天然或工程化EV的制备仍然是异质的,并且包含具有不同组成的囊泡亚群。评估蛋白质负载到EV中的方法主要限于大量蛋白质含量分析方法,例如蛋白质印迹法、酶联免疫吸附测定 (ELISA)、与珠子偶联的EV的常规流式细胞术和质谱法,所有这些都不是适用于单囊泡表征。最近,已经描述了几种用于单囊泡分析的技术,以便更准确地表征蛋白质货物的负载,其中一些技术达到了单分子分辨率。这些包括透射电子显微镜 (TEM) 结合免疫金标记、原子力显微镜、超分辨率荧光显微镜、荧光相关光谱、纳米流式细胞术、成像流式细胞术、单粒子干涉反射成像传感 (SP-IRIS) 和激光镊子拉曼光谱。重要的是,这些方法揭示了天然和工程EV亚群中货物的异质分布,突出了EV标准表征中更高分辨率技术的要求。该研究旨在探索和验证在单囊泡和单分子水平上分析工程化EV的技术,以快速、可靠地评估不同EV分选蛋白在促进蛋白质货物装载方面的效率。Expi293F细胞被设计成分泌装载有绿色荧光蛋白 (GFP) 的EV,这些蛋白融合到选定的膜相关蛋白中,这些蛋白在EV中高度富集。使用Western blotting的标准EV表征技术批量分析小EV中的GFP水平,并与新型高分辨率单囊泡分析方法纳米流式细胞术、ExoView和单分子定位显微镜 (SMLM) 进行比较。研究结果验证了使用NanoAnalyzer N30设备和ExoView的Nanoflow流式细胞术作为快速可靠的技术,用于工程EV的单囊泡分析,捕获跨EV亚群的异质GFP分布。SMLM被验证为最准确的方法,可以量化单个EV中加载的GFP拷贝数。与不同EV分选蛋白融合后GFP富集水平的比较分析还揭示了适用于将蛋白质货物高效加载到EV中的新候选蛋白,扩大了可用于生成工程化EV的EV分选蛋白的范围增强靶向受体细胞的能力,并在功能上递送具有治疗价值的货物。Expi293F细胞被设计成表达与绿色荧光蛋白 (GFP) 融合的EV分选蛋白。特定EV分选域的蛋白质印迹证实了分泌EV中高水平的GFP加载,但纳米流式细胞术的定量单囊泡分析在不到一半的分析颗粒中检测到GFP,反映了EV异质性。ExoView中的抗四次跨膜蛋白EV免疫染色证实了CD63+、CD81+或CD9+ EV不同亚群中的异质GFP分布。通过单分子定位显微镜对GFP加载到单个囊泡中进行量化。综合结果表明TSPAN14、CD63和与PDGFRβ跨膜结构域融合的CD63/CD81是最有效的EV分选蛋白,每个囊泡平均累积50-170个单个GFP分子。总之,该报道验证了一套适用于EV制剂高分辨率分析的互补技术,这些技术可靠地捕获了它们的异质性,并提出了用于EV工程应用的高效EV分选蛋白。在单囊泡和单分子水平上准确表征细胞外囊泡亚群取决于用于囊泡分析的技术方法蛋白质印迹、纳米粒子追踪分析、纳米流式细胞术、ExoView 和 SMLM 在单囊泡和单分子水平分析异质工程化EV亚群的优缺点据悉,BigPharma中布局治疗性外泌体研发的除了阿斯利康(AstraZeneca)外,还有诺和诺德(Novo Nordisk)、安斯泰来(Astellas)、拜耳(BAYER)、武田(Takeda)、赛诺菲(Sanofi)、百时美施贵宝(Bristol Myers Squibb)、罗氏(Roche)等。Silva AM, Lázaro-Ibáñez E, GunnarssonA, Dhande A, Daaboul G, Peacock B, Osteikoetxea X, Salmond N, Friis KP,Shatnyeva O, Dekker N. Quantification of protein cargo loading intoengineered extracellular vesicles at single-vesicle and single-moleculeresolution. J Extracell Vesicles. 2021Aug;10(10):e12130. doi: 10.1002/jev2.12130. Epub 2021 Aug 2. PMID: 34377376;PMCID: PMC8329990.
细胞外囊泡 (EVs) 是几乎所有细胞类型都分泌到细胞外空间或体液中的纳米级颗粒,通过生物分子的功能转移来传递细胞间通讯。EVs已被探索为用于治疗人类疾病的治疗药物分子的天然递送载体。事实上,EVs已显示出作为各种类型治疗性货物的细胞内递送的新型候选物的巨大潜力,包括合成小分子和生物分子,如RNA和大蛋白质。此外,与合成递送系统相比,这些囊泡具有几个优点,包括体积小、免疫原性低、无细胞毒性、长期安全性以及通过多种策略装载货物。EVs可以被设计,用感兴趣的分子来改变它们的货物组成。特别是,蛋白质货物对EVs的修饰通常是通过细胞工程实现的,质粒编码和过表达融合到腔内或膜蛋白的目标蛋白,在它们的生物发生过程中自然掺入EV。为此目的选择的EV蛋白通常富含于EV制剂,有可能促进高水平的选择性货物装载到囊泡中,因此,这里被指定为EV分选蛋白。常用的EV分选蛋白包括四跨膜蛋白(尤其是CD63、CD9和CD81)、lamp2b和乳粘素的C1C2结构域。选择的货物蛋白与EV分选蛋白的融合是最常报道的通过亲本细胞工程将蛋白质货物加载到EV中的策略。这种方法既可以在腔内储存可以输送到靶细胞的货物,也可以在EV表面展示货物,通过与靶细胞表面受体的直接相互作用来增强它们的治疗信号特性或靶向能力。据报道,已成功加载到EV中的蛋白质货物包括用于体外和体内EV跟踪的荧光素酶和荧光蛋白、用于EV靶向的抗体和肽、活性酶、用于同时将RNA加载到EV中的RNA结合蛋白和疫苗免疫原等。有趣的是,其中许多研究表明,装载到EV中的货物蛋白的富集水平取决于所使用的EV分选蛋白。然而,对不同EV分选蛋白的装载效率的综合比较仍仅限于少数候选蛋白,由于缺乏对货物装载进行定量分析的工具而进一步受到影响。细胞中有多种生物发生途径导致EV的释放,这解释了在细胞条件培养基中存在具有不同成分的异质囊泡群。即使是通过目前可用的最具体的方法分离的天然或工程化EV的制备仍然是异质的,并且包含具有不同组成的囊泡亚群。评估蛋白质负载到EV中的方法主要限于大量蛋白质含量分析方法,例如蛋白质印迹法、酶联免疫吸附测定 (ELISA)、与珠子偶联的EV的常规流式细胞术和质谱法,所有这些都不是适用于单囊泡表征。最近,已经描述了几种用于单囊泡分析的技术,以便更准确地表征蛋白质货物的负载,其中一些技术达到了单分子分辨率。这些包括透射电子显微镜 (TEM) 结合免疫金标记、原子力显微镜、超分辨率荧光显微镜、荧光相关光谱、纳米流式细胞术、成像流式细胞术、单粒子干涉反射成像传感 (SP-IRIS) 和激光镊子拉曼光谱。重要的是,这些方法揭示了天然和工程EV亚群中货物的异质分布,突出了EV标准表征中更高分辨率技术的要求。该研究旨在探索和验证在单囊泡和单分子水平上分析工程化EV的技术,以快速、可靠地评估不同EV分选蛋白在促进蛋白质货物装载方面的效率。Expi293F细胞被设计成分泌装载有绿色荧光蛋白 (GFP) 的EV,这些蛋白融合到选定的膜相关蛋白中,这些蛋白在EV中高度富集。使用Western blotting的标准EV表征技术批量分析小EV中的GFP水平,并与新型高分辨率单囊泡分析方法纳米流式细胞术、ExoView和单分子定位显微镜 (SMLM) 进行比较。研究结果验证了使用NanoAnalyzer N30设备和ExoView的Nanoflow流式细胞术作为快速可靠的技术,用于工程EV的单囊泡分析,捕获跨EV亚群的异质GFP分布。SMLM被验证为最准确的方法,可以量化单个EV中加载的GFP拷贝数。与不同EV分选蛋白融合后GFP富集水平的比较分析还揭示了适用于将蛋白质货物高效加载到EV中的新候选蛋白,扩大了可用于生成工程化EV的EV分选蛋白的范围增强靶向受体细胞的能力,并在功能上递送具有治疗价值的货物。Expi293F细胞被设计成表达与绿色荧光蛋白 (GFP) 融合的EV分选蛋白。特定EV分选域的蛋白质印迹证实了分泌EV中高水平的GFP加载,但纳米流式细胞术的定量单囊泡分析在不到一半的分析颗粒中检测到GFP,反映了EV异质性。ExoView中的抗四次跨膜蛋白EV免疫染色证实了CD63+、CD81+或CD9+ EV不同亚群中的异质GFP分布。通过单分子定位显微镜对GFP加载到单个囊泡中进行量化。综合结果表明TSPAN14、CD63和与PDGFRβ跨膜结构域融合的CD63/CD81是最有效的EV分选蛋白,每个囊泡平均累积50-170个单个GFP分子。总之,该报道验证了一套适用于EV制剂高分辨率分析的互补技术,这些技术可靠地捕获了它们的异质性,并提出了用于EV工程应用的高效EV分选蛋白。在单囊泡和单分子水平上准确表征细胞外囊泡亚群取决于用于囊泡分析的技术方法蛋白质印迹、纳米粒子追踪分析、纳米流式细胞术、ExoView 和 SMLM 在单囊泡和单分子水平分析异质工程化EV亚群的优缺点据悉,BigPharma中布局治疗性外泌体研发的除了阿斯利康(AstraZeneca)外,还有诺和诺德(Novo Nordisk)、安斯泰来(Astellas)、拜耳(BAYER)、武田(Takeda)、赛诺菲(Sanofi)、百时美施贵宝(Bristol Myers Squibb)、罗氏(Roche)等。Silva AM, Lázaro-Ibáñez E, GunnarssonA, Dhande A, Daaboul G, Peacock B, Osteikoetxea X, Salmond N, Friis KP,Shatnyeva O, Dekker N. Quantification of protein cargo loading intoengineered extracellular vesicles at single-vesicle and single-moleculeresolution. J Extracell Vesicles. 2021Aug;10(10):e12130. doi: 10.1002/jev2.12130. Epub 2021 Aug 2. PMID: 34377376;PMCID: PMC8329990.外泌体资讯网 【JEV】阿斯利康研发中心:以单囊泡和单分子分辨率定量加载到工程细胞外囊泡中的蛋白质货物