炎性小体可响应病原体和与危险相关的分子模式而被激活,从而促进炎症反应。放射疗法可诱导抗肿瘤免疫反应和炎症小体激活,但炎症小体激活如何促进抗肿瘤免疫尚不清楚。德克萨斯大学西南医学中心傅阳心教授等近日在Science Immunology杂志上发表文章,报道了使用基因敲除小鼠模型研究发现,AIM2和NRLP3炎性小体均是辐射诱导的抗肿瘤免疫所必需的。这些炎症小体诱导IL-1β成熟,以IL-1R介导的方式激活树突状细胞,从而导致T细胞活化和抗肿瘤免疫。IL-1β的局部治疗逆转了小鼠肿瘤模型的放射线抵抗力。
炎性小体是一种胞质多蛋白复合物,是对病原体和危险相关分子模式(PAMP和DAMP)的响应而形成的,在宿主抵抗感染和肿瘤发生的防御中起着关键作用。核苷酸结合和寡聚化域(NOD)样受体(NLR)家族中有几种胞质模式识别受体(PRR)与炎症小体的形成和激活有关,包括NLRP1、NL RP3、NLRP6和NLRC4。NLRP3是最有特色的NLR,可识别各种PAMP和DAMP,包括DNA、5'-三磷酸腺苷和活性氧(ROS)。胞质DNA传感器黑素瘤缺乏因子2(AIM2)是形成PRR的非NLR炎性小体,它也参与了炎性小体的激活。通过它们的特定配体激活后,NLRP3或AIM2通过包含C端胱天蛋白酶募集结构域(ASC)的衔接子蛋白凋亡相关斑点样蛋白与caspase-1(CASP1)相互作用,形成大的多分子炎症小体复合物。这种相互作用激活了CASP1,该酶裂解白介素-1β(IL-1β)和IL-18产生它们的成熟形式。IL-1β具有多种生物学功能,包括淋巴细胞活化和嗜中性粒细胞募集到局部组织。IL-1β结合到Myolid细胞或T细胞上的IL-1R1后,通过激活NF-κB、MAPK和AP1来增强趋化因子和促炎细胞因子的分泌。趋化因子和细胞因子的分泌建立了炎症感染区域或肿瘤组织中的微环境。
与许多诱发促炎性免疫反应的急性感染不同,肿瘤促进慢性炎症建立免疫抑制性肿瘤微环境(TME)。值得注意的是,炎性小体在肿瘤诱导的免疫抑制和肿瘤发生中起作用,特别是在炎症诱导的癌症中。此外,新出现的证据表明,阻断炎性体介导的IL-1信号传导可能有助于控制肿瘤的生长。在Casp1-/-小鼠中或在阻断IL-1信号传导时,肿瘤的生长较慢。一些化学治疗剂,例如吉西他滨和5-氟尿嘧啶,激活NLRP3炎性小体,导致IL-1β的分泌。用IL-1R拮抗剂阻断IL-1R信号传导可增强吉西他滨和5-氟尿嘧啶的抗肿瘤作用,并减少肿瘤的发展和转移。在临床试验中,阻断IL-1R信号作为一种癌症治疗方法正在被广泛研究。
放射疗法(RT)被广泛用作癌症治疗。放射功效主要依赖于直接杀死肿瘤细胞和随后诱导的免疫反应,对此仍然知之甚少。T细胞介导的抗肿瘤免疫有助于局部消融性RT后的肿瘤抑制。可以通过环状GMP(鸟苷5'-单磷酸)-AMP(腺苷5'-单磷酸)合酶(cGAS)-干扰素基因途径(STING)的刺激来检测肿瘤来源的双链DNA(dsDNA),导致I型干扰素(IFN)的表达,这在T细胞活化和随后的肿瘤消退中起着核心作用。除cGAS之外,DNA还可以通过其他几种PRR来检测,但人们对这些PRR及其相关免疫途径在RT期间抗肿瘤免疫中的确切作用了解甚少。AIM2和NLRP3有助于辐射诱导的细胞死亡和组织损伤。巨噬细胞中的病毒感染诱导了AIM2炎性小体的激活,从而限制了cGAS-STING途径。这表明炎性体可能抑制RT介导的抗肿瘤免疫反应。但是,该研究发现Casp1-/-小鼠中的肿瘤比对照小鼠生长更慢,并且对RT有抵抗力。具体而言,辐射诱导了AIM2和NLRP3炎性小体的激活,这与巨噬细胞中IL-1的产生和随后的树突状细胞(DC)的激活相关。这种DC激活导致更强的T细胞免疫应答和强大的抗肿瘤免疫力。
AIM2和NLRP3炎性小体对放射疗法(RT)的作用
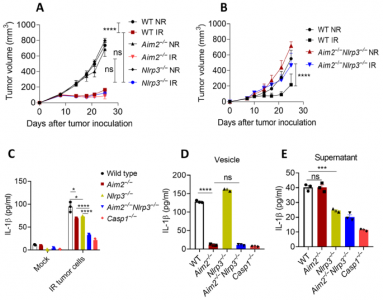
该研究观察到,与野生型(WT)小鼠相比,在Casp1-/-小鼠中移植的肿瘤对放射治疗具有抵抗力。为了确定炎性体途径中的哪个分子促成这种抵抗,该文研究了辐射在几种炎性体缺陷型小鼠中的抗肿瘤作用。与WT小鼠一样,在Aim2-/-或Nlrp3-/-小鼠中生长的肿瘤仍然对放射线敏感,而Aim2-/-Nlrp3-/-小鼠则显示出抗辐射性。从机制上讲,来自被照射肿瘤的细胞外囊泡(EVs)和不含EV的上清液可激活巨噬细胞中的Aim2和Nlrp3炎性小体,从而导致白介素1β(IL-1β)的产生。IL-1β治疗有助于克服Casp1-/-和Aim2-/-Nlrp3-/-小鼠体内生长的肿瘤的放射抗性。树突状细胞(DC)中的IL-1信号传导通过增强DC的交叉启动活性来促进辐射诱导的抗肿瘤免疫力。总体而言,该研究证明了辐射诱导的AIM2和NLRP3炎性小体的激活通过触发DC中的IL-1信号传导,从而诱导了辐射的一些抗肿瘤作用,从而导致它们的激活和交叉引发。
参考文献:
Han C, Godfrey V, Liu Z, Han Y, Liu L, Peng H, Weichselbaum RR, Zaki H, Fu YX. The AIM2 and NLRP3 inflammasomes trigger IL-1-mediated antitumor effects during radiation. Science Immunology. 2021 May 7;6(59):eabc6998. PMID: 33963060.