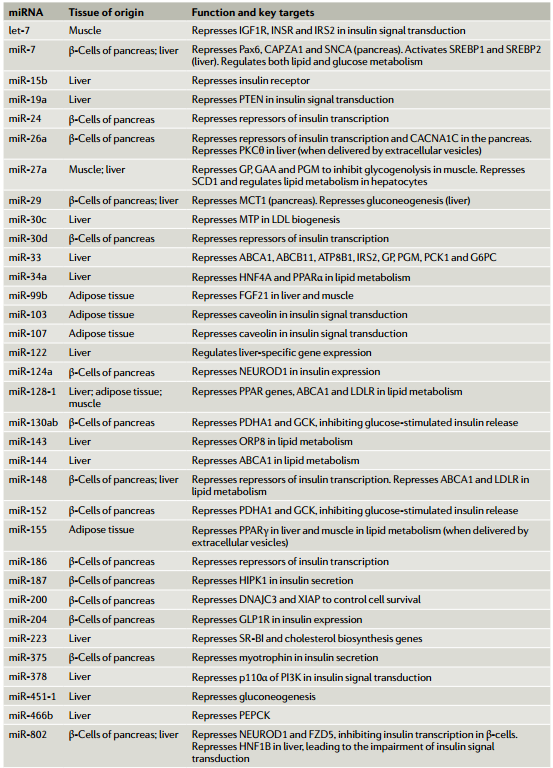
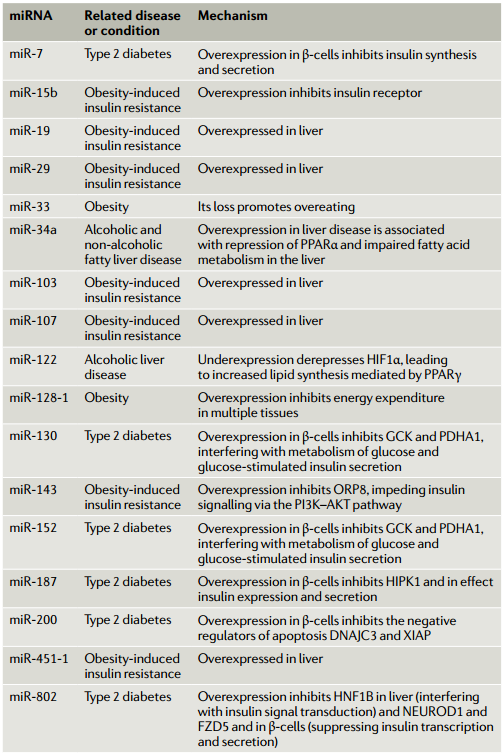
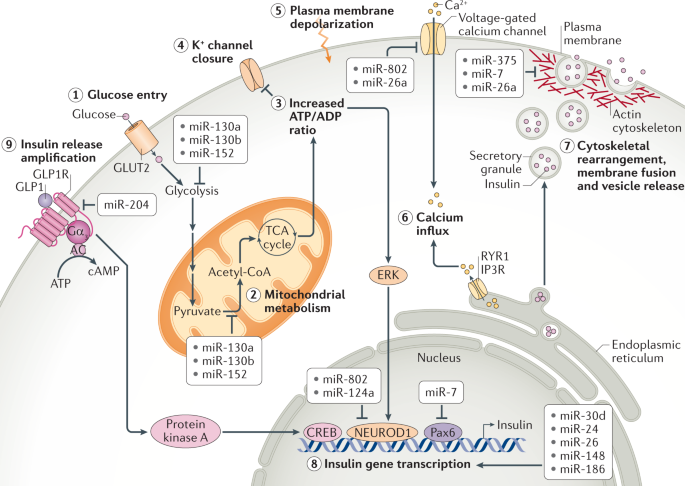
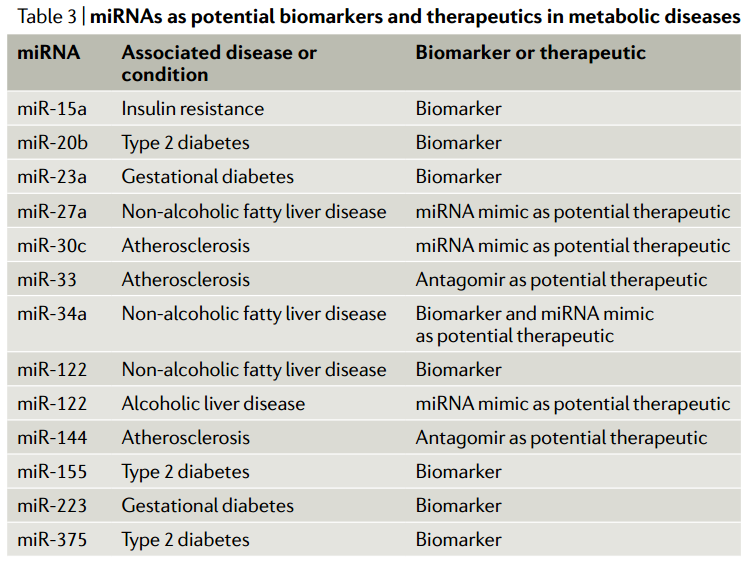
微小RNA(miRNA)是广泛存在的转录后基因抑制物家族,与基因表达的调节相关,包括系统地调节新陈代谢。近日,Nature Reviews Molecular Cell Biology杂志(影响因子55.470)发表了题为“MicroRNA-mediated regulationof glucose and lipid metabolism”的综述,该综述着重于葡萄糖和脂质的代谢,回顾了有关miRNA在其系统调节中的作用的当前知识。该文调查了miRNA介导的健康代谢调控,以及miRNA对疾病(尤其是糖尿病、肥胖症和肝病)代谢功能障碍的贡献。尽管大多数miRNA对其产生的组织起作用,但现在已经确定,miRNA也可以在体液中循环,包括通过细胞外囊泡的细胞间转运。该文讨论了此类细胞外miRNA在系统性代谢控制中的作用、以及作为代谢状态和代谢疾病的生物标志物的潜在作用。图 1:胰岛β细胞中胰岛素的合成和分泌及其受miRNA的控制葡萄糖的流入及其对胰腺β细胞胰岛素合成和分泌的影响。数字1–9是指胰岛素释放的不同步骤。(1)葡萄糖通过转运蛋白GLUT2进入细胞。(2)然后通过糖酵解在细胞质和三羧酸(TCA)循环在线粒体中进行代谢,生成ATP。(3)这增加了细胞中ATP/ADP的比例。(4)K+离子通道可检测到较高的ATP/ADP比并关闭,(5)从而导致质膜去极化。(6)这可以通过一个电压门控的钙离子通道来感知,该通道会打开,导致Ca2+涌入。钙水平的升高触发肌动蛋白细胞骨架的重排和胰岛素分泌颗粒与质膜的对接,从而导致其融合和释放。(8)同时,ERK感觉到较高的ATP/ADP比并激活转录因子NEUROD1以增强胰岛素基因的转录。胰岛素释放的第一阶段之后是第二个更持久的阶段,该阶段涉及大量的细胞骨架重排以及胰岛素囊泡从细胞内储存区到质膜的长距离运输。(9)胰高血糖素样肽1(GLP1)与GLP1R的结合通过cAMP-蛋白激酶A信号转导途径增强了这些过程。与调节胰岛素有关的β-细胞中表达的微小RNA(miRNA)主要参与拮抗胰岛素合成和释放的各个步骤。它们减弱GLP1信号转导,抑制胰岛素基因转录,减少钙向细胞质中的流入,并降低分泌性颗粒的对接和释放。但是,一小部分miRNA也显示出促进胰岛素合成的作用。大于200 nm的细胞外囊泡被称为“微囊泡”,是由质膜向外发芽形成的。较小的细胞外囊泡是通过质膜的向外发芽分泌ectosomes或通过多囊泡体(MVB)与质膜融合而形成的。MVB由晚期的内体通过内体膜的内向出芽形成腔内囊泡而形成。当MVB与质膜融合时,内部囊泡作为外泌体释放到细胞外环境中。由miRNA和Ago蛋白组成的RISC不仅在胞质溶胶中游离存在,而且很大一部分RISC与晚期内体有物理联系。RISC的内体缔合及其在该细胞区室中的沉默活性取决于成熟为MVB的内体,RISC随之定位在MVBs的腔内囊泡中。然后,这为miRNA的分泌提供了一条途径,但尚不清楚它是否是唯一的途径,可能微囊泡和ectosomes也可以转运miRNAs。血清中的细胞外囊泡中装有miRNAs。这使得循环miRNAs成为一个令人兴奋的新兴研究领域,以了解基因调节的新机制以及在疾病诊断和治疗中的应用。随着循环miRNA的鉴定,一个重点领域变成了了解这些miRNA的起源、目的和功能。在代谢组织中,脂肪组织和胰腺β细胞已被证明是循环miRNA的重要来源。源自脂肪组织的miRNA在代谢调节中起主要作用。小鼠脂肪组织中Dicer1的特异性敲除导致循环miRNA水平的总体下降。在确定的653种循环miRNA中,有419种的水平中Dicer1基因敲除小鼠的循环中降低或消除。Dicer1基因敲除小鼠还显示出胰岛素抵抗,可以通过移植野生型脂肪或将野生型小鼠血清中的细胞外囊泡注射到这些小鼠中来逆转。miR-99b负责下调健康肝脏和肌肉中成纤维细胞生长因子FGF21的表达。这些结果表明循环miRNA可以作为调节葡萄糖稳态的脂肪因子。脂肪组织来源的miRNA在有氧运动中也可能对代谢表现产生影响。与具有野生型脂肪组织的小鼠不同,具有Dicer脂肪组织特异性损失的小鼠对有氧运动训练的反应较差。运动还可以增加脂肪组织中的miRNA水平,这表明这些miRNA可能会分泌到细胞外的小泡中,这些小泡全身性地充当脂肪因子来介导对健康活动(例如运动)的反应。在与脂肪组织炎症相关的肥胖症中,脂肪组织巨噬细胞可能是循环miRNA的重要来源。从肥胖小鼠脂肪组织巨噬细胞分泌的一种这样的miRNA是miR-155。它通过抑制肝脏和肌肉等目标组织中PPARγ的表达来抑制胰岛素信号转导。一种预测是,肥胖症可能会导致循环miRNA失衡,这可能会导致糖尿病的进展。实际上,将来自肥胖小鼠的循环细胞外囊泡注射到瘦小鼠中会导致瘦宿主体内出现系统性胰岛素抵抗和葡萄糖耐受不良。甚至装有模拟富含肥胖相关的miRNA的合成细胞外囊泡也具有相同的作用。相反,将瘦小鼠的细胞外囊泡注入肥胖小鼠可减轻其胰岛素抵抗。这表明,载有特定miRNA的细胞外囊泡可作为治疗糖尿病进展的疗法进行探索。循环miRNA的另一个来源是胰腺β细胞。miRNA可从培养物中生长的β细胞分泌的,它们可以调节共培养的β细胞的活性。如果细胞暴露于促炎性细胞因子,它们的细胞外囊泡miRNA谱会发生变化,并且这种细胞外囊泡会诱导幼稚的β细胞凋亡。miR-26a在β细胞中具有自主功能(如前所述,可调节葡萄糖刺激的胰岛素分泌)、在小鼠的胰岛素靶组织中具有非自主功能。令人惊讶的是,来自肥胖小鼠和人类的循环细胞外囊泡中的miR-26a丰度大大降低。当miR-26a实验性地在小鼠的β细胞中过表达时,循环的细胞外囊泡中就充满了miR-26a,这与胰岛素敏感性以及肝脏、肌肉和脂肪中的代谢稳态显著增加有关。进一步表明,暴露于miR-26a超负荷的细胞外囊泡的小鼠原代肝细胞下调了PKCθ表达,并在体外对胰岛素的反应中显示出PI3K–AKT信号转导增加。尽管对这类循环miRNA在受体细胞中的命运和作用仍知之甚少,但有证据表明它们在摄取后可能调节基因表达和代谢。这些循环的miRNA大大扩展了组织之间的信号传导和协调范围,它们对代谢疾病的诊断和治疗具有广阔的前景(表3)。
总之,尽管自28年前发现以来就对miRNA进行了广泛的研究,但它们仍使我们感到惊讶,并且我们期望发现其机制和功能将为今后许多年提供充足的研究机会。AgbuP, Carthew RW. MicroRNA-mediated regulation of glucose and lipid metabolism.Nat Rev Mol Cell Biol. 2021 Mar 26. PMID: 33772227.外泌体资讯网 55分Nature Reviews:miRNA介导的葡萄糖和脂质代谢调节