癌细胞通常显示出异常的细胞外囊泡(EVs)生成,从而增强肿瘤的进展,但其潜在机制尚不清楚。近日Current Biology杂志上一篇文章报道了肿瘤细胞相关的中心体扩增导致溶酶体功能障碍,并导致促进恶性的外泌体异常分泌。
Nature Reviews Molecular Cell Biology杂志进行了Highlight推荐。
多种人类癌症类型通常在中心体的结构和数量上表现出缺陷,这些中心体是动物细胞中主要的微管组织中心。在果蝇和小鼠模型中的工作表明,中心体异常,特别是中心体扩增,不仅是肿瘤发生的副产物,而且在促进和加速肿瘤进展中起直接作用。
尽管尚未完全解析中心体异常促成肿瘤发生,但中心体扩增可直接促进非整倍性和细胞侵袭,这在恶性进展中起重要作用。 最近,该团队报道了中心体扩增诱导具有促侵袭特性的几种蛋白质的分泌,例如白介素8,其诱导邻近细胞的侵袭行为。这种分泌变化部分是由于应激反应,这种应激反应是由中心体扩增下游的活性氧(ROS)增加所引起的。因此,扩增的中心体的存在还可以通过蛋白质分泌以非细胞自主的方式影响肿瘤,提示这些异常在癌症中的作用更广泛、更复杂。
细胞因子、生长因子和细胞外囊泡(EVs)的分泌促进癌细胞与肿瘤微环境之间的双向通讯。这种串扰会影响肿瘤的发生、进展和患者的预后。EVs是膜结合的囊泡,其中包含蛋白质、脂质、DNA和RNA(microRNA、mRNA和长非编码RNA),可以介导细胞之间分子的水平转移。它们在细胞-细胞通讯中的作用特别令人关注,因为它们被怀疑具有长效作用,并且能够在转移前的利基形成过程中影响远处的组织。真核细胞分泌两种主要类型的EVs,微泡和外泌体,它们的大小和生物发生途径不同。微囊泡(大EV [LEVs;直径约100-1,000 nm])是通过质膜的向外发芽或“脱落”而形成的。相比之下,外泌体(小EV [SEV];直径约30-150 nm)在细胞内生成为多囊泡体内的腔内囊泡,多囊泡体与质膜融合后释放。 两种类型的EVs均可由癌细胞分泌,并已显示可能在其组成变化中在肿瘤进展中发挥关键作用。
外泌体是SEV的一种亚型,对塑造肿瘤微环境至关重要。这在间质隔室中尤其明显,在这种间质隔室中,癌症来源的外泌体可以通过分子转移(例如转化生长因子β(TGF-β))来激活成纤维细胞。成纤维细胞活化导致细胞外基质(ECM)沉积、肿瘤纤维化和转移。这在胰腺癌中尤其重要,在胰腺癌中,成肌纤维细胞样星状细胞的活化和随之而来的纤维化是这些肿瘤的高度侵袭性和较差的治疗功效的主要贡献者。尽管已知一些外泌体成分有助于成纤维细胞的活化和募集(例如,TGF-β和Lin28B),但导致其包装和癌细胞中分泌改变的途径仍是未知的。
该报道的研究表明多余的中心体的存在足以增加SEV的分泌,但不足以增加LEV的分泌。通过免疫电子显微镜(IEM)对这些SEV进行表征,并通过细胞培养条件下稳定同位素标记技术(SILAC)蛋白质组学分析,表明它们是内吞起源的,因此富含外泌体。从机理上讲,该研究发现溶酶体功能的破坏是额外的中心体增加细胞中ROS的结果,阻止了有效的溶酶体和多囊泡体融合,从而导致SEV分泌。此外,与具有正常中心体数的胰管腺癌(PDAC)细胞分泌的SEV相比,具有额外中心体的细胞分泌的SEV在功能上是不同的,可以诱导胰腺星状细胞(PSC)激活。因此,用具有额外中心体的癌细胞的SEV预处理的PSC会促进PDAC细胞在异型3D培养物中的侵袭。该发现表明,中心体扩增可促进分泌型SEV的数量和质量变化,从而可能影响肿瘤与相关基质之间的通讯,进而促进恶性肿瘤。
要点:
- 中心体扩增诱导小细胞外囊泡(SEV)分泌
- 蛋白质组学分析表明,分泌的SEV是内吞起源的
- 溶酶体功能障碍导致具有额外中心体的细胞分泌SEV
- 具有额外中心体的PDAC分泌的SEV激活胰腺星状细胞
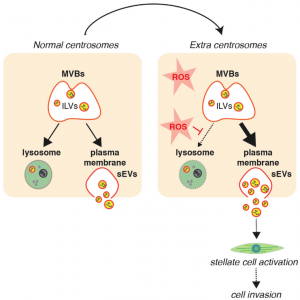
模式图
中心体异常,特别是过剩的中心体,促成肿瘤发生。有报道发现具有高水平中心体扩增水平的胰腺导管腺癌(PDAC)细胞具有增加的活性氧水平,从而破坏了溶酶体功能,导致外泌体分泌增加(两种类型EVs中较小的一种)。溶酶体功能障碍干扰外泌体起源的多囊泡体的降解,导致向质膜的转运增加和外泌体分泌增加。
具有额外中心体的PDAC细胞分泌的外泌体在功能上不同于具有正常数量中心体的细胞分泌的外泌体。当将胰腺星状细胞(导致胰腺纤维化以及PDAC的侵袭性、转移性的关键因素)与这些外泌体一起孵育时,细胞被激活并促进异型3D培养物中胰腺癌细胞的侵袭。
因此,具有多余中心体的癌细胞分泌的外泌体可能会改变微环境,从而增强侵袭潜能。
参考文献:
BaumannK. Making more exosomes. Nat Rev Mol Cell Biol.2021 Mar 8. PMID: 33686231.
Adams SD,Csere J, D'angelo G, Carter EP, Romao M, Arnandis T, Dodel M, Kocher HM, GroseR, Raposo G, Mardakheh F, Godinho SA. Centrosome amplification mediates smallextracellular vesicle secretion via lysosome disruption. Curr Biol.2021 Feb 9:S0960-9822(21)00061-0. PMID: 33592190.