近日,北卡罗来纳大学黄力夫教授团队在NatureNanotechnology杂志(影响因子31.538)上发表文章,报道了肝巨噬细胞充当松弛素介导的肝纤维化缓解的中心枢纽,外泌体在其中发挥重要作用,介导了肝巨噬细胞和肝星状细胞之间的串扰。松弛素诱导的巨噬细胞外泌体miR-30a-5p通过靶向ASK1使肝星状细胞失活,从而达到缓解肝纤维化的作用。 
活化的肝星状细胞(aHSC)是肝纤维化的主要效应细胞,在慢性肝损伤过程中产生过多的细胞外基质(ECM)。最近的证据表明,aHSCs可以在体内逆转为静态表型,这有助于解决肝纤维化。该团队先前的研究证明了肝纤维化的自发消退与内源性肽激素松弛素(RLN)之间的关联。aHSC上的松弛素受体家族肽-1(RXFP1)的上调促进RLN结合和恢复为静止状态。尽管已证明外源引入RLN可以使患病肝脏中的aHSC失活,但确切的潜在机制仍不清楚。除aHSCs以外,巨噬细胞还被认为是纤维生成过程中的“双刃剑”,这表明在肝纤维化的进展和消退过程中,两种细胞之间存在潜在的相互作用。巨噬细胞具有响应环境因素的表型可塑性。骨髓来源的Ly6C高表达(Ly6Chi)巨噬细胞占受伤肝脏中巨噬细胞总数的大部分。肝巨噬细胞的这种亚型具有炎症性,并且通过产生纤维化原因子(例如TGF-β)和血小板衍生的生长因子(PDGF),对于肝星状细胞(HSC)活化至关重要。在纤维化消退期间,Ly6Chi巨噬细胞发生表型转换为Ly6C低表达(Ly6Clo)亚型,其特征在于基质金属蛋白酶(MMP)的上调和炎性细胞因子的下调。然而,这些特性是否使Ly6Clo巨噬细胞具有解决纤维化的能力尚待确定。对控制巨噬细胞表型转换的特定机制以及随后与aHSC相互作用以使肝纤维化消退的更详细的了解可能会为新型抗纤维化策略提供参考。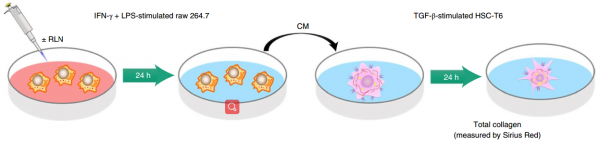
促炎性巨噬细胞与TGF-β激活的HSC之间相互作用的体外模拟示意图该研究发现,尽管在体内纤维化肝脏中增强的RLN表达具有很强的抗纤维化功效,但是用RLN体外处理aHSC未能使细胞失活或减少ECM沉积。这种差异表明,aHSC周围的微环境有助于RLN介导的抗纤维化作用,进而触发了该研究发现RXFP1在肝巨噬细胞表面表达的发现。RLN与RXFP1的结合通过孤核受体Nur77的激活促进了巨噬细胞表型从Ly6Chi转变为Ly6Clo。肝巨噬细胞耗竭和体外共培养系统证明Ly6Clo巨噬细胞作为RLN调控的aHSC失活的中间体起着至关重要的作用。进一步研究证明,从这些巨噬细胞释放的外泌体负责介导巨噬细胞和aHSC之间的串扰。具体来说,来自RLN处理的巨噬细胞的外泌体的microRNA(miRNA)分析显示miR-30a-5p的上调,一旦被aHSC吸收,它就会靶向凋亡信号调节激酶1(ASK1),并且可以克服aHSCs促纤维化激活引起的PPAR-γ不足。PPAR-γ表达的上调最终使aHSC对RLN介导的失活敏感。最后,验证了miR-30a-5p向aHSCs的靶向递送可协同RLN基因治疗,而组合基因治疗可在多种肝纤维化模型中实现增强的抗纤维化作用。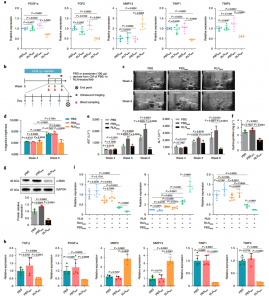
RLN处理的巨噬细胞通过外泌体释放使aHSCs失活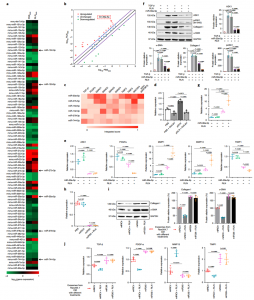
RLN诱导的巨噬细胞外泌体miR-30a-5p通过靶向ASK1使aHSCs失活简言之,松弛素是一种抗纤维蛋白肽激素,以前被认为可以直接逆转肝星状细胞的活化以解决肝纤维化。使用纳米颗粒介导的传递,该研究表明,尽管松弛素基因疗法可降低体内肝纤维化,但体外治疗无法诱导活化的肝星状细胞静止。肝巨噬细胞表达主要的松弛素受体,并且在松弛素结合时,它们从促纤维化表型转变为抗纤维化表型。后者释放外泌体,从而通过miR-30a-5p促进松弛素介导的活化肝星状细胞的静止。在这些结果的基础上开发了脂质纳米颗粒,该脂质纳米颗粒优先靶向纤维化肝脏中的活化肝星状细胞,并封装了松弛素基因和miR-30a-5p模拟物。组合基因疗法可在小鼠肝纤维化模型中实现协同抗纤维化作用。总的来说,该发现突出了巨噬细胞在松弛素引发的肝纤维化缓解中所起的关键作用,并证明了通过纳米技术和基础科学的互补应用来设计抗纤维化策略的概念验证方法。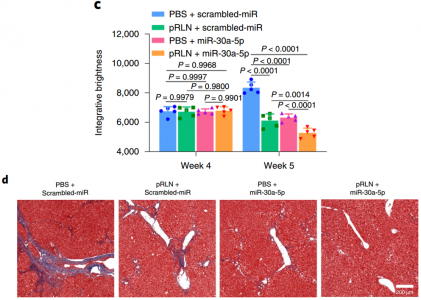
pRLN LPD与miR-30a-5pLPH的组合在ccl4诱导的肝纤维化模型中达到协同抗纤维化作用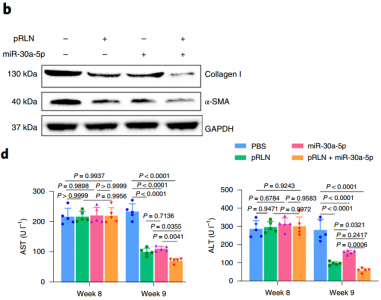
RLN LPD与miR-30a-5pLPH的组合在cDaHFD诱导的脂肪性肝炎模型中实现了协同的抗纤维化作用LPD:lipid–protamine–DNA nanoparticles conjugated with aminoethyl anisamide (AEAA)LPH:lipid–protamine–hyaluronic acid nanoparticles conjugated with aminoethylanisamide (AEAA)HuM, Wang Y, Liu Z, Yu Z, Guan K, Liu M, Wang M, Tan J, Huang L. Hepatic macrophages act as a central hub for relaxin-mediated alleviation of liver fibrosis. Nat Nanotechnol. 2021 Jan 25. doi:10.1038/s41565-020-00836-6. PMID: 33495618.外泌体资讯网 Nature Nanotechnology:松弛素通过肝巨噬细胞外泌体介导肝纤维化的缓解