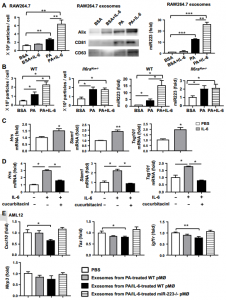
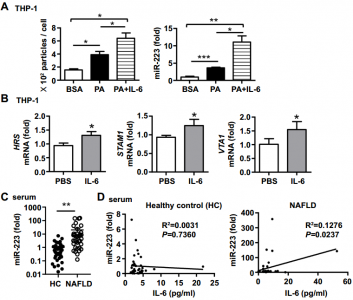
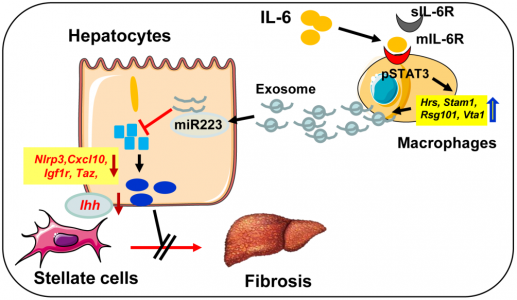
非酒精性脂肪肝疾病(NAFLD)与许多细胞因子尤其是IL-6升高有关;但是,IL-6在NAFLD中的作用仍然不清楚。安徽医科大学王华教授课题组在Hepatology杂志(影响因子14.679)上发表文章,报道了髓样特异性IL-6信号通过外泌体将抗纤维化的miR-223转移到肝细胞中来抑制肝纤维化,为NAFLD治疗提供了新的治疗靶点。非酒精性脂肪肝疾病(NAFLD)是全球慢性肝病的最主要原因。它代表了一系列疾病,从单纯性脂肪变性到非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌。通常认为炎症在NAFLD的进展中起关键作用。但是,炎症对NAFLD进展,尤其是对肝纤维化的确切影响仍然不清楚。IL-6是一种多效性细胞因子,在炎症中起着复杂的作用,在控制包括NAFLD在内的所有类型疾病的发病机理中起着重要作用。NASH患者的血清、肝和脂肪IL-6水平升高与胰岛素抵抗、脂肪变性和肝损伤有关。喂高脂饮食(HFD)的小鼠中IL-6水平也升高,IL-6的基因缺失增强了HFD诱导的脂肪变性和肝损伤。相反,在蛋氨酸和胆碱缺乏的饮食诱导的另一种NASH模型中,IL-6基因的缺失可减轻肝脏损伤和炎症。这些关于IL-6在NAFLD中的作用的矛盾数据可能是由于所使用的模型不同以及广泛表达的膜结合IL-6受体α(mIL-6Rα)及其信号链gp130以及可溶性IL-6R(sIL-6R)和可溶性gp130(sgp130)的存在。Gp130普遍存在,而IL-6Rα的表达主要限于肝细胞、巨核细胞和白细胞子集。包括巨噬细胞和嗜中性粒细胞在内的髓样细胞表达IL-6Rα,是肥胖相关炎症的关键介质。尽管巨噬细胞已在NASH的早期阶段与促炎表型有关,但它们可在肝脏疾病的慢性消退阶段采用恢复性表型来限制肝纤维化。髓样特异性IL-6信号在控制NAFLD进展中的作用仍然未知。IL-6通过与mIL-6Rα的结合激活经典信号传导,从而导致gp130二聚化和随后的Janus激酶(JAKs)以及STAT3的激活。活化的STAT3导致IL-6依赖性基因表达和细胞反应,例如急性期反应、增殖、迁移或代谢变化。IL-6还可以通过sIL-6R和gp130进行信号传递,这被称为反信号传递,并允许不表达IL-6Rα的细胞对IL-6作出反应。已经证明IL-6介导的反式信号转导在多种肝功能例如肝再生中起作用。sIL-6R以前被认为是通过IL-6-sIL-6R促进IL-6反信号转导而成为系统性缓冲系统。然而,最近的一项研究表明,IL-6-sIL-6R复合物的形成频率比以前预期的低得多,这表明即使在sIL-6R处于超过IL-6的高摩尔浓度的条件下,通过mIL-6R进行的经典IL-6信号传导仍具有活性。先前的研究证明,IL-6 KO小鼠在3个月的HFD喂养后更容易受到肝损伤和脂肪变性的影响。但是,未观察到肝纤维化和肝癌发生。该研究对IL-6 KO和WT小鼠进行了长期(一年)HFD喂养,并检查了这些小鼠的肝损伤和癌症。在两种的IL-6受体a(Il6ra)条件性KO小鼠中进一步检查了细胞特异性IL-6信号在NAFLD中的作用,包括肝细胞特异性(Il6raHep-/-)和骨髓特异性(Il6raMye-//)KO小鼠。有趣的是,喂3个月的HFD后,Il6raMye-/-小鼠比WT小鼠更容易受到肝纤维化的影响,尽管敲除小鼠的肝中性粒细胞和巨噬细胞浸润较少。研究发现了一种新的机制,髓系IL-6信号转导改善了HFD诱导的肝纤维化:IL-6促进巨噬细胞释放富含miR-223的外泌体,这些外泌体可能转移到肝细胞中,从而抑制了几个miR-223靶基因的表达。包括已知促进NASH纤维化的具有PDZ结合基序的转录激活因子(Taz),含NOD、LRR和吡啶结构域的蛋白3(Nlrp3),CXC基序趋化因子10(Cxcl10)。细胞外囊泡(EVs)是细胞在生理和病理条件下释放到细胞外空间的膜结合小囊泡。根据其细胞的生物发生和大小,EVs可分为三类:外泌体(大小为40 nm-150 nm直径)、微囊泡/微粒(MPs,直径为50nm-1,000 nm)和凋亡小体(直径> 500 nm)。外泌体携带蛋白质、miRNA、DNA和糖脂,这些蛋白质会影响其受体细胞的细胞功能。最近的研究表明,脂毒性肝细胞可产生外泌体,该外泌体可通过递送各种内容物(包括线粒体DNA和肿瘤坏死因子相关的凋亡诱导配体)来激活巨噬细胞。肝细胞来源的外泌体还可以通过抑制巨噬细胞激活和细胞因子分泌,抑制肝星状细胞(HSC)激活以及诱导细胞外基质降解和重塑来促进纤维化的解决。此外,中性粒细胞和巨噬细胞也可释放外泌体,随后改变肝功能。例如,miR-223是在嗜中性粒细胞和巨噬细胞中表达的最丰富的miRNA之一,在控制包括肝脏疾病在内的各种疾病中的炎症中起关键作用。活化后,中性粒细胞可以通过外泌体将miR-223传递至巨噬细胞或肝细胞,从而抑制NASH和肝纤维化。巨噬细胞还可以通过外泌体将miR-223传递到包括肝细胞在内的多种细胞中,随后它们会影响这些细胞的功能。该研究证明了IL-6可以诱导巨噬细胞和嗜中性粒细胞(尽管程度较小)释放富含miR-223的外泌体,然后将其转移到肝细胞中以抑制肝纤维化。从机制上讲,IL-6通过上调外泌体生物发生相关基因来促进外泌体生物发生,而不会影响pre-miRNA-223的表达。IL-6促进小鼠巨噬细胞产生富含miR-223的外泌体,可抑制肝细胞中miR-223的靶基因IL-6促进人单核细胞中富含miR-223的外泌体生产招募患有NAFLD或非酒精性脂肪性肝炎(NASH)和健康对照的患者,并检测血清IL-6和可溶性IL-6受体α(sIL-6Rα)水平。与对照组相比,NAFLD/NASH患者的血清IL-6和sIL-6Rα水平升高。IL-6水平与循环白细胞和单核细胞数量呈正相关。在动物模型中,高脂饮食(HFD)喂养后,在Il6基因敲除(KO)和Il6受体A(Il6ra)条件性KO小鼠中研究了IL-6在NAFLD中的作用。由HFD喂养的Il6 KO小鼠与WT小鼠相比,肝损伤和纤维化更严重,但炎症较少。肝细胞特异性的Il6ra KO小鼠脂肪变性和肝损伤更多,而髓样特异性的Il6ra KO小鼠肝浸润性巨噬细胞和嗜中性粒细胞数量减少,这些细胞的细胞死亡增加,但肝纤维化程度比野生型小鼠高。从机理上讲,HFD喂养的髓样特异性Il6ra KO小鼠肝纤维化增加是由于抗纤维化miR-223减少以及随后带有PDZ结合基序(TAZ)的miR-223目标基因转录激活因子的上调所致;这是促进NASH纤维化的因素。在体外,IL-6处理上调了与外泌体生物发生有关的基因,并随后促进巨噬细胞释放富含miR-223的外泌体,这些外泌体能够通过外泌体转移减少肝细胞中促纤维化TAZ的表达。最后,NAFLD患者的血清IL-6和miR-223水平升高并相互关联。HouX, Yin S, Ren R, Liu S, Yong L, Liu Y, Li Y, Zheng MH, Kunos G, Gao B, Wang H.Myeloid cell-specific IL-6 signaling promotes miR-223-enriched exosomeproduction to attenuate NAFLD-associated fibrosis. Hepatology.2020 Nov 24.外泌体资讯网 Hepatology:外泌体miR-223减轻与NAFLD相关的纤维化