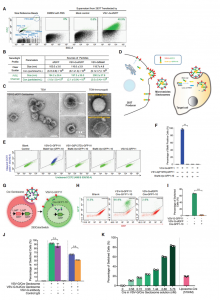
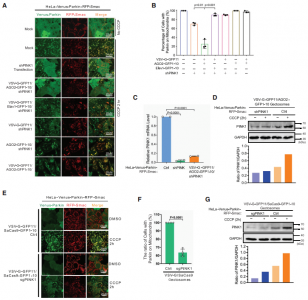
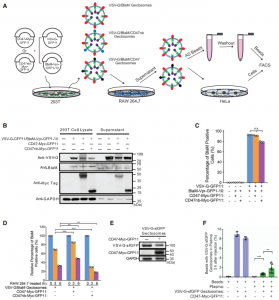
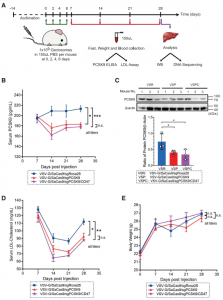
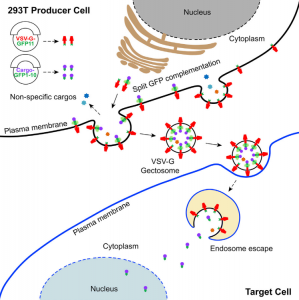
美国科罗拉多大学生物化学系刘学东教授团队在Developmental Cell 杂志发表文章,报道开发了一种工程化的细胞外囊泡(EVs),该囊泡可实现有效的货物装载和内体逃逸同时进行大分子的细胞内递送。研究表明,这些可编程EVs提高了货物装载的特异性,并提高了将功能蛋白或RNP递送到细胞和小鼠体内的效率。研究人员和制药行业对将大分子(例如蛋白质和核酸)递送到哺乳动物细胞中的能力非常感兴趣。基因修饰和干扰mRNA表达的创新方法已成为生物医学研究中必不可少的工具。所有这些方法都依赖于将核酸、蛋白质或核糖核蛋白(RNP)递送至靶细胞的细胞内空间,但这是有困难的,因为细胞膜和内体膜大部分对生物制剂是不可渗透的。克服这些障碍递送生物分子仍然是一个重大挑战。细胞外囊泡(EVs)是异质的、纳米大小的膜囊泡,可以被所有细胞类型组成性或诱导性释放。由于EVs已被越来越多地视为在细胞之间运输生物活性分子的天然手段,因此人们对EVs作为治疗手段的研究兴趣日益浓厚。但是,要实现EVs的转化潜力,需要解决几个关键问题。首先,在条件培养基或体液中存在各种EVs,包括外泌体、ectosomes /微泡、凋亡小体和外泌颗粒(exomeres)。分离和纯化大量单一类型的EVs仍然难以实现。其次,由于EVs的成分异质性,其特定的活性往往较低。在某些应用中,在体外用siRNA加载外泌体显著提高了封装的治疗性核酸的活性和功效。但是,尚不清楚该策略是否可以扩展到更大的生物分子,例如蛋白质或RNP。最后,蛋白质组学和RNA-seq分析揭示了EVs组成的大量多样性和异质性。如何控制每种囊泡封装的分子货物并降低EV成分的异质性仍然是挑战。该研究报告了一种制备可编程的、高度融合的囊泡的通用方法,作者称其为“Gectosomes”(VSV-G蛋白囊泡),作为体外和体内剂量控制性递送生物活性大分子的载体。从水泡性口炎病毒递送的机制和水泡性口炎病毒G蛋白(VSV-G)的充分融合活性中借鉴,使用分离的GFP系统开发了一种活性的Gectosome装货策略。建模和实验研究表明,通过GFP互补主动装载Gectosome,大大提高了货物转运至靶细胞的效率,减少了细胞蛋白的非特异性封装,并有助于纯化Gectosomes。通过成功地胞内递送胞质和核酶证明了这种方法的多功能性和广泛的适用性,从而在培养的细胞和小鼠体内肝组织中进行了DNA重组、RNA干扰和基因编辑。由于Gectosomes是经过基因编码、高度可编程、易于制备并且可以根据其货物进行纯化的,因此这种方法简化了基因组修饰实验,可以适应广泛的研究和可能的治疗应用。使用封装Cre、Ago2和SaCas9的Gectosome,证明了它们能够在体外细胞系和体内小鼠肝组织中执行内源基因的设计修饰,从而为该技术在广泛人类疾病范围内的应用铺平了道路。细胞间转移特定蛋白的两组分荧光Gectosome的开发Gectosomes可以将多种货物递送至靶细胞并编程基因表达通过系统性Gectosomes传递基因编辑器在小鼠肝脏中编辑PCSK9基因Zhang X, Xu Q, Zi Z, Liu Z, Wan C, Crisman L, Shen J, Liu X.Programmable Extracellular Vesicles for Macromolecule Delivery and Genome Modifications.Dev Cell. 2020 Dec 21;55(6):784-801.e9. Epub 2020 Dec 8.PMID: 33296682.外泌体资讯网 Cell子刊:可编程的细胞外囊泡用于大分子递送和基因组修饰