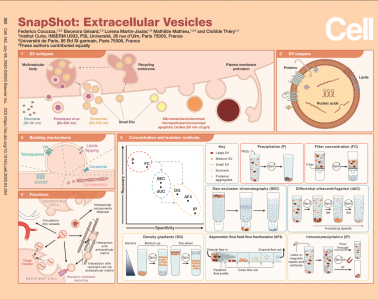
细胞外囊泡(EVs)是所有细胞释放到其环境中的结构。它们由脂质双层包裹,并包含释放它们的细胞中的成分。EV可以在多囊室(通常具有内吞性质)中形成腔内囊泡(ILV)的形式,并在这些区室与质膜融合后分泌(外泌体)。其他EV可以直接从质膜释放(ectosomes、微囊泡、微粒、大的oncosomes和凋亡小体)。因为原核细胞没有内部隔室,所以它们的EVs只能起源于其细胞膜。包膜病毒会劫持被感染细胞的膜来释放,也可以被认为是一种EV。EVs具有与细胞相同的膜取向:表面有脂质和跨膜蛋白的胞外结构域,并包裹细胞质成分(蛋白质和核酸等)。由于EVs包含来自原始细胞的成分,因此,EVs也被视为生物流体中循环生物标记的来源。最近,一些比较蛋白质组学研究发现了特定的EV亚型有特异性的蛋白质。然而,由于难以在各类研究中找到一致的标记物,因此尚未明确鉴定出特定EV亚型的标记物蛋白。EV出芽可能有几种机制,包括以下一种或多种机制的组合:ESCRT复合物、四跨膜蛋白、鞘磷脂产生圆锥形脂质(神经酰胺)、磷脂向膜要出芽的位置重新定位,以及肌动蛋白细胞骨架解聚。这些机制中的某些已在外泌体或ectosome形成中进行了有过相关报道,但不能排除它们可能参与两者的出芽。因此,尚不清楚特定的生物发生机制。EVs已被认为是一种用于分泌细胞的,处置有害或无用的细胞内成分的手段,而且是与其他细胞通讯的重要介体。EVs运载各种货物,这些货物可以传递信号以诱导受体细胞的生理变化。例如, EVs表面带有可以与的靶细胞上同源受体结合的配体,从而介导信号级联反应。内化的 EVs可能会降解,成为受体细胞营养的来源。EVs的内容物还可以转移到靶细胞的细胞质中并在靶细胞中表现出活性。非病毒 EVs的转移机制尚不清楚。EVs可以介导分泌细胞与周围细胞外基质(ECM)的相互作用。此外,存放在ECM中的EV还可以用作与附近单元的间接通信。EVs还可以在远距离通讯中发挥作用,因为它们可以释放到血液或淋巴管中,并将其内含物传递到远处的靶细胞。(5) 我们如何分离不同类型的EVs和共分离组分?通过低速离心去除细胞后,从培养细胞的条件培养基或生物流体中分离出 EVs。不同类型的 EVs显示出重叠的生物物理特性。内吞区室的ILV直径约为100 nm:因此,外泌体的直径范围为50–150 nm。在质膜上形成的EV可以在此尺寸范围内或更大(最大5 mm)。可以发现其他来源未知且形成方式未知的细胞外纳米颗粒(ENP),例如“exomeres”。外泌颗粒(exomeres)包含蛋白质、核酸和脂质,并且处于EV尺寸的最低范围内(大约或小于50 nm)。某些细胞类型和生物流体中释放的各种非囊泡脂蛋白也与 EVs在大小和密度上重叠。由于这些重叠的特性,大多数EV分离方法在不同程度上共分离某些其他细胞外结构,或者不分离不同的EV亚型。该文介绍了一些最常用的技术,将它们按分离效率与特异性进行排名。特异性可以考虑为EVs的(与其他ENP相对)特异性,也可以考虑为特定 EVs亚型的特异性。通过过滤(FC)或基于聚合物的沉淀(P)(例如,使用PEG、聚乙二醇)进行全局浓缩的方法可以回收EV、ENP和大多数其他分泌产物。可以通过大小排阻色谱法将EV与可溶性成分和某些脂蛋白分离(SEC,可溶性成分和最小的脂蛋白在柱中停留的时间更长)。在这些方法中,EV亚型具有稍有不同但重叠的属性,因此,EV亚群的分离效率不高。根据大小和/或重量进行EV亚型的分离可以使用不同离心力/时间的差速离心(dUC)。这种方法可以富集(但不能纯化)特定大小范围的 EVs,并且ENP以及可溶成分是非特异性共分离的,尤其是最小的 EVs。EV亚型和ENP的进一步分离可通过自下而上的密度梯度(DG):非脂质结构不会向上浮动。另外,也可以通过自上而下的DG或密度垫将它们分开:可溶成分不进入梯度。EV亚型和ENP的分离也可以通过基于大小的不对称流分馏(AF4)实现。最后,最特异性的分离可以通过免疫沉淀(IP)来实现,该免疫沉淀使用针对特定 EVs表面蛋白的特异性抗体进行。通常,必须先结合使用多种技术,才能浓缩EVs,然后实现更好的分离特异性。FedericoCocozza, Eleonora Grisard, Lorena Martin-Jaular, Mathilde Mathieu, ClotildeThéry. SnapShot: Extracellular Vesicles Cell. 2020Jul 9;182(1):262-262.e1. doi: 10.1016/j.cell.2020.04.054.外泌体资讯网 【Cell】SnapShot: Extracellular Vesicles | Théry大牛最新





