土豆
脂肪细胞在乳腺癌进展中起到了关键作用,但其中的的调节机制此前并不完全清楚。来自武汉大学人民医院孙圣荣、汪长华课题组的研究人员发现,外泌体miRNA介导了肿瘤细胞与脂肪细胞之间的串联,并通过诱导脂肪细胞向米色/棕色分化以及代谢重编程促进肿瘤进展。该研究发表于5月28日的Journal of Experimental & Clinical Cancer Research杂志上(IF 6.217)。
众所周知,肿瘤的进展不仅受肿瘤细胞的影响,还受周围基质组织细胞的影响。在乳腺癌侵袭和转移过程中,肿瘤细胞和微环境基质细胞之间发生相互和动态的交流。肿瘤细胞通过促细胞间的相互作用将正常基质成分转变为有利于肿瘤生长的微环境,并从基质中攫取促肿瘤代谢物包括乳酸、丙酮酸、脂肪酸和酮体等。
脂肪细胞是构成乳腺癌微环境的主要细胞成分,其与乳腺癌细胞相互作用后,转化为肿瘤相关脂肪细胞(cancer-associated adipocytes,CAA)并促进肿瘤进展。研究表明,脂肪细胞作为内分泌细胞,可产生丰富的炎症因子、生长因子和细胞因子,刺激受体酪氨酸激酶信号传导和上皮间质转化(EMT)。脂肪细胞作为主要的能量储存细胞,也提供了一些高能代谢物。脂肪细胞的代谢重编程使得其具有潜在的肿瘤促进能力,并且推测肿瘤可通过乳腺癌细胞和脂肪细胞之间的动态相互作用重编程脂肪细胞代谢以促进肿瘤进展。
外泌体是小的(30-100nm)膜包裹的囊泡,其被许多细胞类型(包括肿瘤细胞)释放到细胞外微环境中,这是细胞间通信的重要模式。这种细胞与细胞的生物学交流是通过外泌体内容物的交换介导的,外泌体内容物由mRNA、ncRNA、转录因子、蛋白质和脂质组成。研究证明外泌体可以被许多肿瘤类型释放,并且可以通过一些膜特异的标记物(CD63、CD81和TSG101等)的表达情况来鉴定。而且,外泌体miRNA谱与其来源肿瘤细胞的表达谱是相似的。miRNA在肿瘤的发生、发展和转移中起重要作用。此前,研究团队已经证明源自肿瘤细胞的外泌体介导了基质细胞和肌细胞的代谢变化,但外泌体在脂肪细胞的肿瘤转化中的潜在作用尚未阐明。因此,研究人员认为,外泌体可能将特定miRNA从乳腺癌细胞递送到乳腺癌微环境中的脂肪细胞,导致脂肪细胞向CAA的转化。
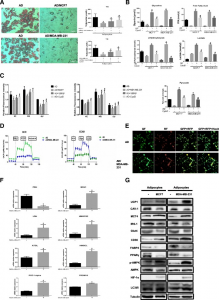
肿瘤诱导的米色和棕色脂肪组织分化促进了乳腺癌的代谢旺盛状态。在这项研究中,研究人员发现,肿瘤周围的脂肪细胞在分化为米色和棕色脂肪细胞表型时表现出活化的分解代谢状态,并伴随着大量的代谢物的释放,包括游离脂肪酸、丙酮酸、乳酸和酮体。其中,肿瘤细胞来源的外泌体与脂肪细胞共培养后,这些现象尤其显著。同时,与成熟脂肪细胞共培养的肿瘤细胞在体外和体内表现出代谢适应和侵袭性表型。在机制上,肿瘤细胞通过包裹高水平miRNA-144和miRNA-126的外泌体诱导脂肪细胞中的米色棕色表型分化和代谢重编程。 外泌体miRNA-144通过下调MAP3K8 / ERK1/2 /PPARγ通路促进米色棕色脂肪细胞特征。外泌体miRNA-126通过抑制IRS / Glut-4信号,激活AMPK相关的自噬途径并促进HIF1α表达来实现代谢调控。体内实验里,抑制miRNA-144或miRNA-126减少了脂肪细胞诱导的肿瘤生长。这些结果表明,在这种肿瘤细胞与脂肪细胞的相互作用过程中,外泌体miRNA-144和miRNA-126通过诱导脂肪细胞的米色/棕色分化并增强受体脂肪细胞中的分解代谢,重编程肿瘤代谢最终促进肿瘤进展。
图:与乳腺癌细胞共培养后,脂肪细胞表现出米色/棕色脂肪细胞特征增加,并出现大量的代谢变化
参考文献:Wu Q, Li J, Li Z, Sun S, Zhu S, Wang L, Wu J, Yuan J, Zhang Y, Sun S, Wang C. Exosomes from the tumour-adipocyte interplay stimulate beige/brown differentiation and reprogram metabolism in stromal adipocytes to promote tumour progression. J Exp Clin Cancer Res. 2019 May 28;38(1):223.