作者:企鹅
人们正在探究干细胞和祖细胞用于再生医学应用;然而,移植后跟踪细胞并确定治疗效果仍然具有挑战性。来自美国马里兰大学和宾夕法尼亚大学的研究人员最近在Science Translational Medicine发表文章,从血液中分离外泌体来监测心脏梗死后移植到大鼠心脏中的人心肌球源细胞(cardiosphere-derived cells, CDCs)和心脏祖细胞(cardiac progenitor cells, CPC)。他们发现,可以根据主要组织相容性复合物错配纯化CDC/CPC衍生的外泌体,并且外泌体含有与心肌修复相关的microRNA。体外培养皿中培养的CPC/CDC产生的外泌体的内容物与移植到体内的细胞产生的外泌体的内容物不同。该研究表明,循环外泌体可用于非侵入性地监测移植细胞。
小编注:这里我们不讨论c-kit+细胞是否心脏干细胞,以及心脏是否有干细胞的问题。姑且将该文中提到的c-kit+心脏祖细胞(CPC)认做是一类心梗移植有效的c-kit+细胞。
基于干/祖细胞的疗法在临床前移植和组织损伤模型中发挥不同程度的疾病治疗作用。这些疗法现在在人体临床试验中显示出有希望的结果。最近,相关研究已经证明与成人衍生的CPC或CDC相比,来自人新生儿心脏组织的心脏祖细胞(CPC; c-kit+/Lin−)和心肌球源细胞(CDCs)可更好地减少心脏瘢痕大小,改善心功能,并减轻不良的心肌重塑。尽管在成人缺血性心脏病中使用CPC或CDC移植进行了1期临床试验,但增强其临床疗效的一个主要限制因素是在心肌重塑期间无法无创地监测移植细胞及其治疗效果。
此外,移植的心脏干/祖细胞的驻留率低。干细胞分泌组的成分,包括外泌体,通过供体年龄依赖性途径促进心肌恢复。与心脏修复有关的外泌体研究的指数增加突出了这些含有miRNA的小囊泡(30至150 nm)的治疗潜力,这些囊泡来自多泡体与质膜的融合。外泌体携带修复受损心脏所需的蛋白质,以及miRNA,它们能够通过改变靶细胞的转录组来促进长期修复。
尽管CPC或CDC的心肌内移植在临床前研究中挽救了梗死的心肌并改善心功能,但是对于CPC或CDC的有益作用的潜在机制尚不清楚。之前,该研究团队对CPC分泌组进行了深入分析,证明单次心肌内注射来自新生儿CPC的外泌体可促进心肌恢复,与新生儿CPC注射后观察到的作用相当。这些结果表明,CPC或CDC至少部分治疗功效可能归因于它们的外泌体。此前,已有研究报道在受体的血浆中观察到来自移植的实体器官的循环组织特异性外泌体。外泌体含有特异的蛋白质组和RNA特征,反映其来源细胞的状态。
最近,该研究团队还证明了循环中移植组织特异性外泌体表征能够以时间敏感、条件特异性的方式对移植的实体器官进行无创监测。因此,研究人员假设移植的干/祖细胞将外泌体信号释放到外周循环中,干/祖细胞特异性外泌体的表征将能够对移植细胞的功能活性和条件状态进行无创监测。然而,尚不清楚移植的干/祖细胞衍生的外泌体是否具有与其体外培养的祖/干细胞类似的miRNA特征,以及是否能够通过检测和使用这些循环外泌体用于移植祖细胞驻留和活性的非侵入性监测。
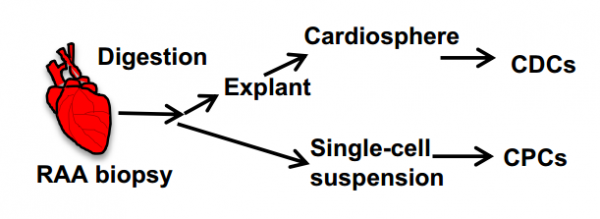
干细胞移植的应用因没有简单高效的无创监测靶器官内移植细胞的方法而受到阻碍。该研究假设在受体血浆中定量和表征移植细胞衍生的外泌体将能够对移植细胞的条件活性进行可靠的、非侵入性的监测。为了验证这一假设,研究人员使用了一种人-大鼠异种心肌梗死模型,比较了两种研究较多的祖细胞类型:心肌来源细胞(CDCs)和c-kit+心脏祖细胞(CPC),两者都来自接受体外循环的成人的右心耳。
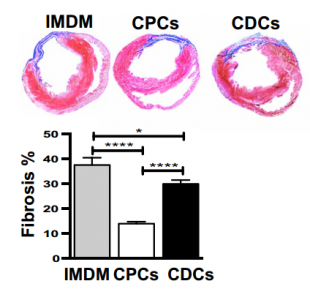
实验结果发现,在基于细胞和体内再生测定中,CPC优于CDC。
移植细胞减小梗死面积
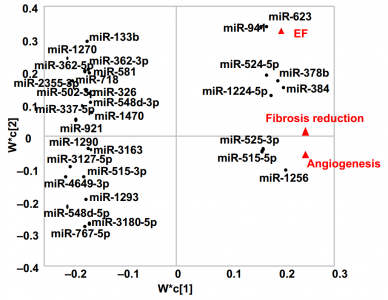
为了在体内非侵入性地监测移植的CDC或CPC的活性,研究人员从受体总血浆外泌体中纯化了祖细胞特异性外泌体。移植后7天,与CDC特异性外泌体相比,血浆CPC特异性外泌体的浓度增加约两倍。生物信息学的通路分析未能将CPC或CDC细胞mRNA与观察到的心肌修复联系起来,但与受体血浆中纯化的CPC外泌体的miRNA有关。研究进一步确定了与移植的CPC相关的心肌修复的机制。
循环中源自移植细胞的外泌体miRNA的PLSR和功能分析
总之,该研究证明祖细胞特异性外泌体存在于受体循环中并且可以非侵入性地监测。在异种啮齿动物MI模型中进行了head-to-head比较,以研究来自相同人类心脏活检的两个充分研究的祖细胞,CDC和CPC的心脏修复潜力。验证了干/祖细胞特异性外泌体的监测潜力,并证明外泌体miRNA反映了移植干细胞的功能性心肌修复。这些发现证明了循环中祖细胞特异性外泌体作为液体活检的潜力,其为移植细胞的状态提供了非侵入性监测的方案。这些数据揭示了细胞特异性外泌体对同种异体细胞疗法的监测潜力。
参考文献
- Sharma, R. Mishra, G. E. Bigham, B. Wehman, M. M. Khan, H. Xu, P. Saha, Y. A. Goo, S. R. Datla, L. Chen, M. E. Tulapurkar, B. S. Taylor, P. Yang, S. Karathanasis, D. R. Goodlett, S. Kaushal, A deep proteome analysis identifies the complete secretome as the functional unit of human cardiac progenitor cells. Circ. Res. 120, 816–834 (2017).
Saha P, Sharma S, Korutla L, Datla SR, Shoja-Taheri F, Mishra R, Bigham GE, Sarkar M, Morales D, Bittle G, Gunasekaran M, Ambastha C, Arfat MY1, Li D, Habertheuer A, Hu R, Platt MO, Yang P, Davis ME, Vallabhajosyula P, Kaushal S. Circulating exosomes derived from transplanted progenitor cells aid the functional recovery of ischemic myocardium. Sci Transl Med. 2019 May 22;11(493). pii: eaau1168. doi: 10.1126/scitranslmed.aau1168.